Blog de cursos y estudiantes de Químicas del Departamento de Ciencias Quimico-Biológicas en la Universidad de las Américas Puebla.
Sunday, May 04, 2008
Preguntas y Respuestas: Isolobalidad
En teoría los fragmentos isolobales deberían tener una estabilidad similar al interactuar con el resto de la molecula. Sin embargo hay ocasiones en que se presentan estabilidades diferentes a las esperadas debido a las condiciones electrónicas de cada fragmento.
¿Por qué quiso molestar a Corey?
Roald Hoffman trabajo muchos años con Woodward, al recibir el premio Nobel de Química Corey pretendió sacarle crédito de la idea después de la muerte de Woodward. Lo que hizo enfurecer a Roald Hoffman por lo que en el discurso para recibir el premio Nobel de Química en 1981, decidió hablar de otra cosa totalmente diferente.
¿Cuál es la estabilidad de estos compuestos?
No siempre se puede predecir la estabilidad de los compuestos a los que se hace un intercambio de fragmentos isolobales.
¿Por qué Mn(CO)5 y el CH3 son isolobales al ver que su diagrama mostrado es muy diferente?
A pesar de que los fragmentos isolobales no tengan un diagrama de TOM igual también se puede decir que estos fragmentos son isolobales si el número de propiedades de simetría, la energía y forma de los orbitales frontera además del número de electrones, son similares mas no iguales.
¿Qué información extra puede darnos saber acerca de la isolobalidad de una molécula?
Se puede predecir la reactividad y estructura de una molécula en base a otro fragmento que le sea isolobal con una química más conocida
Mencione 5 ejemplos de fragmentos isolobales
Mn (CO)5 es isolobal a CH3, Cr (CO)5, Mo (CO)5 y W (CO)5
Saturday, May 03, 2008
Respuestas a las preguntas de la exposición de boranos
Las piramides pentagonales del nido-RR' C2B4H42 y nido-RR'C2B4H5- aniones son ligandos para metales muy versatiles, debido a que estabilizan a la molécula colando en el centro o en la parte superior al metal. Esta habilidadse debe a que se forman enlaces fuertemente covalentes con metales del grupo principal o metales de transición y mucho más fuerte con Cp- o sistemas con arenos, en donde se explota principalmente la estabilidad de arquitecturas moleculares inusules. Una ventaja es especial en los complejos metal-C2B4 (siete vértices clusters MC2B4) es la facilidad para remplazar los atomos de boro por ligandos metálicos o unidades B-X lo que provca una arma sintética poderosa en la construcción de electrónia y nanomateriales.
Los carbonos bifuncionales han sido utilizados en diferentes reacciones de nucleótidos en donde se incluyen varios radiometales utilizados en el diseño de nanomateriales que funcioen para diagnosticar diversas enfermedades.
Friday, May 02, 2008
Respuesta a preguntas: Nuevos Alótropos de Nitrógeno
El N5+ presenta una estabilidad bastante alta en estado gaseoso debido a las estructuras resonantes que se pueden formar, aunque las resonancias que se han descrito son estructuras de Lewis, la verdadera estructura aún se desconoce. Las estructuras del N12 no presentan una muy alta estabilidad debido a que al ser cadenas muy largas, se pueden descomponer muy fácilmente. Para el N8 se sabe que la estabilidad es alta, ya que el intercambio entre las cargas positivas internas y externas de los nitrógenos, se estabilizan con gran facilidad en una especie de dipolo.
¿Por qué se pueden formar clusters si en el N8 no hay un enlace M-M?
Al haber una carga positiva en el enlace de los nitrógenos del centro, es posible hacer interactuar el mismo compuesto formando cúmulos (clusters en su término en inglés) con la interacción presente que puede haber entre esta carga y la negativa del nitrógeno externa de otra molécula de N8.
¿Por qué las sales del N5 son estables?
Porque proviene de otra sal que es de por sí estable, sólo que ésta posee al alótropo más conocido, el N2, lo cual después de varios intentos por aumentar este alótropo a una interacción de 5 nitrógenos para formar una sal con éste, finalmente al hacer reaccionar N2FSbF6- con HN3 en ácido clorhídrico, se obtuvo la sal estable del N5+SbF6-, la cual a su vez muestra las propiedades de estabilidad de este alótropo.
¿Afecta la tensión angular y el tamaño del nitrógeno en los enlaces?
Sí, como se puede ver en el N8, los anillos formados son aromáticos debido al doble enlace intercalado que existen entre los nitrógenos, lo cual tensa un poco más la estabilidad de algunas moléculas; y el tamaño también llega a afectar ya que existe una atracción de los electrones con mayor fuerza entre los nitrógenos y por lo tanto lo enlaces son más cortos pese a ser dobles y no triples como generalmente se pensaba que podían ser.
¿Cuál es el cluster más estable del nitrógeno?
De los presentados, el N8 es el que muestra una mayor estabilidad, ya que sus fuerzas de dipolo-dipolo y su aromaticidad, así como su facilidad de formar trímeros, dímeros, tetrámeros, etc., ha dado lugar a que su estudio sea posible bajo condiciones normales de presión y temperatura.
¿Los alótropos del nitrógeno pueden ser utilizados en química de coordinación como ligandos polidentados?
Se cree que en un futuro los alótropos pudieran servir como ligandos, pero hasta ahora no se ha logrado estudiar sus interacciones con átomos metálicos, aunque se piensa que el N8 pudiera interactuar con átomos metálicos debido a sus cargas negativas en los extremos y su gran estabilidad presentada.
¿Son explosivos?
No, al no tener en su estructura átomos de oxígeno, estos son incapaces por sí solos de hacer explosión, ya que el catalizador para que sea explosivo el nitrógeno es el oxígeno en sus óxidos y sustituyentes nito.
¿Existe el N60?
No, debido a los pocos enlaces que se pueden formar entre nitrógenos, se cree que el N60 no puede ser sintetizado, además de que éste no adquiría la forma del fullereno, ya que su hibridación sería muy distinta.
¿Cuál es la geometría del N5+ y N12?
El N5+ presenta una geometría plana en forma de V.
El N12 presenta diferentes geometrías, pero la estructura más estable presenta dos anillos de cinco miembros de nitrógeno unidos por dos átomos de nitrógeno con una geometría plana.
Molécula que camina como un humano
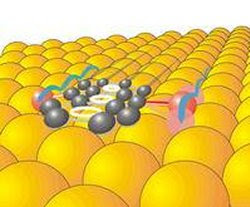
La molécula, cuyo nombre abreviado es "DTA", tiene dos estructuras a modo de pseudópodos, que actúan como pies. Obteniendo su energía del calor proporcionado, la molécula se mueve de tal modo que sólo uno de los pseudópodos se levanta de la superficie; el otro guía el movimiento de la molécula y la mantiene en su trayectoria. Alternando los movimientos de sus dos "pies", la DTA es capaz de caminar en línea recta sin la ayuda de nanorrieles o nanorranuras para guiarse.
Efemérides científicas.
· 1887 - Hannibal W Goodwin solicitó una patente para su película fotográfica de celuloide.
· 1519 - Fallecimiento de Leonardo Da Vinci, que si bien es conocido por su faceta como pintor, desarrolló un impresionante trabajo de investigación científica en campos tan variados como la anatomía humana, la aeronáutica y la mecánica.
· 1979 - Falleció Giulio Natta, conocido por sus descubrimientos en el campo de la química, y premiado con un Nobel en 1963.
· 1963 - Reentrada a la atmósfera terrestre del satélite ruso Sputnik 15 (Cosmos 5).
Orbitales atómicos y moleculares
Podemos encontrar:
- Imágenes representando orbitales atómicos y moleculares.
- Representaciones de funciones de onda.
- Representaciones de densidades electrónicas.
- Representaciones de "densidad de puntos" de los orbitales.
- Representaciones de funciones de distribución radial.
El link es: http://winter.group.shef.ac.uk/orbitron/
La ciencia…¿un pecado mortal?
Otro proceso en el que el NO funciona como mensajero es en la vasodilatación y específicamente en la erección de los hombre. Mientras las parejas intercambian miradas y sonrisas seductoras, los nervios liberan neurotransmisores como la prostaglandina, la acetilcolina y otros que a su vez generan óxido nítrico. Así, mientras la pareja pasa de las miradas y las sonrisa a las caricias y los besos, el NO se disuelve entre los músculos suaves del órgano sexual masculino. Luego, este gas despierta a la enzima guanilato ciclasa. La que activada, acelera la producción de guanosin monofosfato cíclico (GMP-c). Éste se encarga de eliminar el calcio libre. La salida del calcio provoca que se relaje el músculo. Es la tensión del músculo lo que impide que la sangre fluya. Contrariamente a lo que podría pensarse, es al relajarse el músculo que se permite que la sangre fluya causando la erección. La erección termina cuando una enzima, la fosfodiesterasa, degrada al GMP-c haciendo que el calcio regrese a su lugar tensionando al músculo de nueva cuenta. El sildenafil, el principio activo del Viagra, inhibe la acción de esta enzima logrando de este modo curar la disfunción eréctil.
Ahora si podemos decir óxido nítrico es el nombre químico de cupido =D
Respuestas: Clusters
Los clusters tienen varias aplicaciones pero entre las principales se encuentran: en la creación de materiales con propiedades elásticas, magnéticas y eléctricas, en catalizadores de reacciones industriales, en materiales con propiedades superconductivas
- ¿De dónde se obtuvo el futboleno por 1a vez?
En experimentos de espectroscopía molecular, se observaron picos que correspondían a moléculas con una masa molecular exacta de 60, 70 o más átomos de carbono y ahí fue donde descubrieron la estructura del futboleno. Se trata del fulereno más pequeño de C60 en el que ninguno de los pentágonos que lo componen comparten un borde ; si los pentángonos tienen una arista en común, la estructura estará desestabilizada (véase pentaleno). La estructura de C60 es la de una figura geométrica truncada y se asemeja a un balón de fútbol (domo geodésico), constituido por 20 hexágonos y 12 pentágonos, con un átomo de carbón en cada una de las esquinas de los hexágonos y un enlace a lo largo de cada arista.
- ¿Cómo se cambia la hibridación en un cluster?
La hibridación sp2 de los enlaces puede ser cambiado haciendo una adicion nucleofilica a los dobles enlances, permitiendo que se cambie su hibridación a sp2.
- ¿Qué tipo de propiedades magnéticas tiene?
Se ha propuesto que las propiedades magneticas que tienen los clusters se utilizan para producir un efecto magnetocalórico importante en la escala del kelvin (de 1 a 10 K aprox.) y se ha estudiado su dependencia con el proceso de desimanación. Finalmente se ha estudiado un material propuesto para el uso en el llamado papel eléctrico.
- ¿Cómo cambian la hibridación de sp2 a sp3?
Haciendo una adicion nucleofilica a los dobles enlaces del cluster
- ¿Los clusters muy muy grandes también tienen tensión angular?
Algunos clusters grandes pueden llegar a tener tension dependiendo de la conformacion que estos tengan. Hay algunos clusters que son muy estables debido a su conformacion.
- ¿Qué cambios electrónicos se deben de hacer para mejorar la estabilidad del cluster?
Los cambios que se deben hacer es el cambio de hibridación de los angulos para que estos no provoquen una tension tan grande y asi estabilizarlo mas.
-¿Cómo se relaciona la teoría de Pearson a la estabilidad de un cluster metálico?
Se relaciona en el sentido que en su teoria de acidos y bases, duras y blandas menciona que los clusters mas estables se forman mejor con cationes blandos como Cr, Mn, Fe, Ni, etc.
- ¿Qué son los prismanos?
Es un isomero del benceno, y es llamado prismano por que tiene una forma prismática. Tienen una entalpia de formación de 534 kJ/mol.
Thursday, May 01, 2008
carbonos tetracoordinados planos
¿De qué manera las vibraciones de la molécula hacen que se vuelva plana?
Las moléculas no son rígidas pues los átomos de ésta se mantienen en constante vibración. Siendo la geometría de estas moléculas casi plana las vibraciones moleculares pueden conllevar a ciertos momentos en los que la molécula se encuentre plana, pero ya que éstos son movimientos continuos en realidad no se encuentra una estructura fija.
- ¿Cómo se dan las vibraciones en las estructuras planas creadas?
Pueden existir dos tipos de vibración: “Wagging” y “Out-of-plane” pues en estos dos tipos de vibraciones se implican a los movimientos con respecto al plano en que se encuentra la molécula.
- ¿Qué tipo de aplicaciones tienen los tetracarbonos?
Aún no tienen aplicaciones específicas pero quizás por sus características electrónicas y por los sutituyentes que se les agregan como silicio puedan funcionar como semiconductores.
- ¿Cuál es la estabilidad de los compuestos?
En el caso de CSi2Al2 la forma cis es más estable que la trans por 1.023 Kcal/mol y 27.92 Kcal/mol más estable que la forma tetraédrica. Mientras que en la molécula de CSi2Ge2 la forma trans es la más favorable.
¿Qué impedimentos electrónicos existen en la geometría plana del carbono?
Los sustituyentes que se les agregan tienen la capacidad de aceptar la densidad electrónica π del orbital p del carbono y al mismo tiempo donan densidad σ para compensar las necesidades electrónicas del carbono por lo que queda compensado y se llega a la estabilidad.
- ¿Qué ejemplos inorgánicos existen?
Los compuestos de platino son muy comunes por su geometría tetracoordinada plana.
Respuestas exposiciòn CFCs
El efecto de sonochemical (que es utilizado para la descomposiciòn catalitica de los CFCs) es debido a la formación de burbujas en las cavidades y el fluido que crecen por varios ciclos de una onda ultrasónica y luego se derrumban precipitadamente.El derrumbamiento es prácticamente adiabático y conduce a presiones sorprendentemente altas y temperaturas locales. En el agua (51, la presión local puede exceder 500 atm, y la temperatura local puede exceder 5000 K.
Este proceso se encuntra mas detallado en el sig artìculo: http://pubs.acs.org/cgi-bin/abstract.cgi/esthag/1994/28/i09/f-pdf/f_es00058a014.pdf
¿Qué aplicaciones tienen?
Continuan siendo utlizados en los paises tercermundistas como solventes principalmente en aereosoles, esto es debido a que son muy estables y no reaccionan con la sustancia activa, son muy volátiles por lo que a condiciones normales de temperatura y presiónn pasan de la fase líquida del embase a gaseosa y arrastran consigo a la sustancia activa. También son utilizados como gases refrigerantes. Se les dio el prermiso a los paises tercermundistas de continuar usando estos productos mientras logran desarrollarse tecnologicamente que les premitan utilizar otras alternativas.
¿Cuáles son los estudios mas recientes?
En la actualidad, se llevan a cabo estudios basados en mediciones en la atmósfera, y hay grupos importantes que formulan modelos matemáticos, que se basan en los datos experimentales y las mediciones para predecir cómo funciona la atmósfera.
También hay investigaciones sobre alternativas de uso en lugar de CFCs, en la siguiente pág podran encontrar un catálogo de nuevos productos que se estan creando para sustituir a las CFCs. pag: http://www.interempresas.net/FeriaVirtual/Catalogos_y_documentos/175467/ESP%20HFE-71IPA.pdf
¿Cuál sería el proceso de la eliminación de los CFCs para que se reconstruya la capa de ozono?
En la primera pregunta habló un poco sobre las investigaciones al respecto pero, si no lograran usarse estas opciones en la eliminación de estos gases se estima que hasta a finales de siglo se restablecería la capa de ozono, esto también suponiendo que se dejen de emitir los CFCs
¿El fluor no daña a la capa de ozono o solo el carbono?- ¿En qué productos están presentes los clorofluorocarbonos?
El enlace flúor - carbono es muy fuerte (se utiliza en el teflón), lo que destuye el ozono es el cloro, se rompe el enlaze cloro - carbono y se forma el radical libre cloro que es muy reactivo y como la molécula de ozono es muy inestable se escomne con el ataque del cloro en O2 y ClO.
¿Por qué es tan caro los nuevos compuestos fluorados que se utilizan en vez de los CFCs?
No son tan caros, en mi exposición mecioné que lo caro era cambiar toda la infraestructura de un edificio para hacerlos compatible con los nuevos compuestos de hidrogeno, pero el costo es sililar al de poner un sistema de enfriamiento en un edificio nuevo, el problema es que la mayoria de los edificios ya cuentan con la tecnología anterios y ya han hecho esta inversion, pero los nuevos edificios ya estan optando por implementar desde el inicio sistemas de regrigeracion compatibles como compuestos de hidrofluorocarbonos. Otro factor esque los gobiernos impulsan estas alternativas, las financian y apoyan a las empresas para que las usen.
¿Cómo se sintetizan los CFCs?
SbF3Br2 + CCl4 --> CFCl3 + SbF2Br2 Cl
sintesis de CFCs en presencia de SbCl5 como catalizador:
CCl4 + HF --> CFCl3 + CF2Cl2 + HCl
sintesis de (CFC-11) (CFC-12)
CHCl3 + HF --> CHFCl2 + CHF2Cl + HCl
sintesis de (HCFC*-21) (HCFC*-22)
son los mas comunes pero hay otras en las que se usa zn como catalizador y hay otros tipos de CFC, en esta pág. pueden encontrar mas: http://www.chemcases.com/fluoro/fluoro05.htm
CCl2=CCl2 + Cl2 + HF --> CF2ClCFCl2 + CF2ClCF2Cl + HCl
Respuestas: Nuevos compuestos de gases nobles
R= El factor limitante respecto a que compuesto de gas noble se forma y cuál no, parece ser la facilidad que tiene un gas noble de compartir electrones con un átomo de otro elemento electronegativo.
2.- ¿Cuáles serían las aplicaciones del H-Xe-O-Xe-H?
R= Aún no existen concretas aplicaciones a esta moléculas ya que faltan aún estudios por realizar, pero se piensa en un futuro hace algún tipo de polímero con esta molécula.
3.- Si los gases nobles son inertes, ¿cómo es que se forma el XeF2?
R= Se han dado diversos nombres a los elementos del Grupo VIIIA (18). La palabra “inerte” no se puede aplicar como tal a todo el grupo (se emplea como adjetivo específico para el neón y el argón, y no para todo el grupo) debido a que por lo menos tres miembros de la familia no son inertes. El nombre de “gas noble” es el mejo, debido a que implica una resistencia a reaccionar más que una completa renuencia a formar compuestos, siendo paralelo el empleo de este término al que describe la química de ciertos metales como el oro y el platino.
4.- ¿Son explosivos?
R= Son compuestos endotérmicos que explota violentamente a la menor provocación, como cualquier hidrólisis de tipo intencional (o inadvertido) de éstos compuestos será muy riesgosa.
5.- ¿Qué utilización tienen los compuestos de los gases nobles?
R= Imanes superconductores, evitar la oxidación de metales cuando se funden, polímeros.
6.- ¿Cómo cree que podría ser la estructura de la molécula y que estabilidad tiene?
R= Las fuerzas entre los electrones externos de la molécula son más débiles debido a la distancia y la presencia de los otros electrones. La energía obtenida al crear un fluoruro de xenón o radón es mayor que la energía necesaria para promover la reacción, por lo que los compuestos son químicamente estables, aunque los fluoruros y óxidos de xenón son oxidantes fuertes.
7.- ¿Cuáles son las interacciones electrónicas que existen entre el halógeno y el fluor?
R= Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue como se pudo formar compuestos entre el halógeno y el flúor.
Respuestas "FASES DE ZINTL"
1) Mencione algunos ejemplos de clusters tipo clatrato de Zintl:
Pueden ser A8E46, o A24E136, donde A es un metal alcalino y E es un metal del grupo 14, por ejemplo Na8Sn46, o K24Pb136, puede haber otra variante con 1 metales alcalinos diferentes, A’2A”6E46, o A’16A”8E136.Por ejemplo Na2Cs6Pb46, o Cs16K8Sn136.
2) ¿Qué propiedades electrónicas en los metales provocan la estructura de las fases de Zintl?
Pues que son metales ricos en electrones y pueden hacer transferencia de estos, además que los enlaces de los clusters son deslocalizados, así todos los metales los comparten formando el anión de la fase de Zintl.
3) ¿Cómo se da el traslape de orbitales o el enlace correspondiente entre los alcalinoterreos y el grupo p?
El enlace de los metales alcalinos no es directo con el del grupo p, no es una relación 1:1, si no que se forman unos clusters de metales del grupo p como aniones con enlaces deslocalizados y se unen a los metales alcalinos. El enlace es por densidad electrónica.
4) ¿De qué depende la estabilidad de un compuesto de Zintl?
Los compuestos de Zintl no son muy estables de por sí, reaccionan con la humedad del ambiente y con el aire. Su estabilidad depende un tanto del tamaño de los átomos, los clus ters de átomos grandes no son tan estables que los de átomos pequeños, por lo mismo de los traslapes.
ters de átomos grandes no son tan estables que los de átomos pequeños, por lo mismo de los traslapes.
5) ¿Hay clusters dentro otro cluster?
Sí, por ejemplo el Ni@In10@Na36@In74, que es un átomo central de Ni rodeado de un cluster de 10 átomos de indio, y por fuera otro cluster de 74 átomos de indio.
6) ¿Qué otros clusters del grupo 14 se conocen?
Na4Sn4(A4E4) K8Pb9, Cs4Pb9, Cs4Ge9, etc…
7) ¿Por qué se hacen tan pareceidos los clusters a los boranos?
Los clusters deltaedricos están asociados con los boranos y sus derivados porque sus enlaces están deslozlocalizados, y pueden los electrones del sistema pueden ser contados por las reglas de wade, estas reglas pueden, también ser usadas para el conteo de electrones para los clusters, del grupo principal sin sustituyentes, donde se tiene que considerar el hecho de que cada vértice lleva un par solitario de electrones.
8) ¿Podrían ser considerados super-aleaciones?
No, porque a diferencia de las super-aliaciones, los compuestos de Zintl si tienen interacciones intramoleculares tipo enlace con electrones.
9) ¿Por qué no son tan buenos conductores?
Las fases “típicas” de Zintl no lo son, porque son de capa cerrada, sin embargo las “fases metálicas de Zintl” o “casi fases de Zintl” pueden tener propiedades incluso de superconductores ya que tienen electrones extras deslocalizados sobre el átomo de metal alcalino o alcalino terreo.
NEODIMIO ¡no te lo pierdas!

-
De entre todos los compuestos químicos que existen, quizá sean los llamados compuestos de coordinación los que mayores dificultades ofrecen ...
-
Básicamente el video habla por sí sólo. Se tiene una cerveza fría líquida recién sacada del refrigerador o congelador, se le da un golpe y e...
