De entre todos los compuestos químicos que existen, quizá sean los llamados compuestos de coordinación los que mayores dificultades ofrecen a la hora de entender cómo los diferentes átomos están unidos entre sí. Un compuesto de coordinación está formado generalmente por un ión denominado complejo y uno o varios contraiones (iones de carga opuesta a la del ión complejo). El interés de los compuestos de coordinación reside generalmente en las propiedades químicas y físicas del ión complejo, que además de tener unas propiedades químicas muy importantes, presenta propiedades físicas de gran interés, como un intenso color característico de cada complejo, una estructura cristalina bien definida e importantes propiedades magnéticas.
Un ión complejo es un sistema cargado formado por un catión metálico central (generalmente un metal de la serie de transición, con una capa electrónica d parcialmente llena) y una esfera de coordinación formada por iones moleculares (p.ej CN-, OH- EDTA o ión etilendiamintetraacetato), átomos ionizados (p.ej F-, Cl-) o moléculas neutras como el agua, amoníaco, monóxido de carbono. A las especies que forman la esfera de coordinación en el complejo se les denomina ligandos.
El color y las propiedades magnéticas de los complejos se han podido explicar satisfactoriamente a partir de una teoría sencilla conocida como Teoría del campo del cristal. Esta teoría consiste en considerar que los orbitales d del catión metálico central, que en un principio están degenerados es decir, tienen la misma energía) se desdoblan debido a la interacción electrostática con las nubes electrónicas de los ligandos.
Por otra parte, las propiedades magnéticas dependen del número de electrones desapareados. Cuando hay uno o más electrones desapareados, el complejo será paramagnético y se verá atraído por los campos magnéticos en grado proporcional al número de electrones desapareados. Si no hay electrones desapareados, el compuesto será diamagnético y se verá ligeramente repelido por los campos magnéticos.
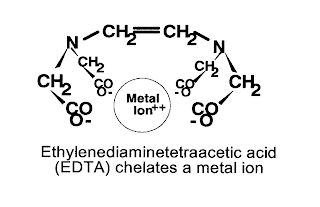
En cuanto a las aplicaciones médicas de los complejos, destacan por ejemplo algunos complejos de Platino, que presentan una marcada actividad antitumoral. Por su parte, el EDTA se puede utilizar como antídoto contra el envenenamiento por metales pesados, ya que forma complejos estables con ellos, que se pueden disolver en agua y ser eliminados por el organismo a través la orina. Además, los complejos juegan un papel fundamental en la vida. Por ejemplo, los glóbulos rojos que el grupo hemo, complejo de hierro que, al oxidarse formando un nuevo complejo es capaz de transportar el oxígeno que las células del organismo necesitan para vivir. A partir de este punto, es fácil comprender por qué el monóxido de carbono es letal para los seres vivos. Al ser un ligando muy fuerte, cuando se respira se fija al hierro del grupo hemo y lo bloquea, incapacitando al glóbulo rojo para transportar oxígeno. Cuando se está en una atmósfera de monóxido de carbono, se produce la muerte por asfixia de forma rápida.
Los complejos poseen también importantes aplicaciones industriales, por ejemplo, para la extracción de metales preciosos de las minas se emplea el cianuro como ligando, ya que facilita la disolución de estos metales, muy díficiles de extraer. También se emplean los complejos como colorantes, especialmente los de la familia de los alumbres. La reacción de formación de dichos compuestos se emplea además por la polícia para detectar el alcohol en el aliento en los controles de alcoholemia.
Un ión complejo es un sistema cargado formado por un catión metálico central (generalmente un metal de la serie de transición, con una capa electrónica d parcialmente llena) y una esfera de coordinación formada por iones moleculares (p.ej CN-, OH- EDTA o ión etilendiamintetraacetato), átomos ionizados (p.ej F-, Cl-) o moléculas neutras como el agua, amoníaco, monóxido de carbono. A las especies que forman la esfera de coordinación en el complejo se les denomina ligandos.
El color y las propiedades magnéticas de los complejos se han podido explicar satisfactoriamente a partir de una teoría sencilla conocida como Teoría del campo del cristal. Esta teoría consiste en considerar que los orbitales d del catión metálico central, que en un principio están degenerados es decir, tienen la misma energía) se desdoblan debido a la interacción electrostática con las nubes electrónicas de los ligandos.
Por otra parte, las propiedades magnéticas dependen del número de electrones desapareados. Cuando hay uno o más electrones desapareados, el complejo será paramagnético y se verá atraído por los campos magnéticos en grado proporcional al número de electrones desapareados. Si no hay electrones desapareados, el compuesto será diamagnético y se verá ligeramente repelido por los campos magnéticos.

En cuanto a las aplicaciones médicas de los complejos, destacan por ejemplo algunos complejos de Platino, que presentan una marcada actividad antitumoral. Por su parte, el EDTA se puede utilizar como antídoto contra el envenenamiento por metales pesados, ya que forma complejos estables con ellos, que se pueden disolver en agua y ser eliminados por el organismo a través la orina. Además, los complejos juegan un papel fundamental en la vida. Por ejemplo, los glóbulos rojos que el grupo hemo, complejo de hierro que, al oxidarse formando un nuevo complejo es capaz de transportar el oxígeno que las células del organismo necesitan para vivir. A partir de este punto, es fácil comprender por qué el monóxido de carbono es letal para los seres vivos. Al ser un ligando muy fuerte, cuando se respira se fija al hierro del grupo hemo y lo bloquea, incapacitando al glóbulo rojo para transportar oxígeno. Cuando se está en una atmósfera de monóxido de carbono, se produce la muerte por asfixia de forma rápida.
Los complejos poseen también importantes aplicaciones industriales, por ejemplo, para la extracción de metales preciosos de las minas se emplea el cianuro como ligando, ya que facilita la disolución de estos metales, muy díficiles de extraer. También se emplean los complejos como colorantes, especialmente los de la familia de los alumbres. La reacción de formación de dichos compuestos se emplea además por la polícia para detectar el alcohol en el aliento en los controles de alcoholemia.



1 comment:
Interesante información. Gracias por compartir.
Post a Comment