Blog de cursos y estudiantes de Químicas del Departamento de Ciencias Quimico-Biológicas en la Universidad de las Américas Puebla.
Monday, April 30, 2007
Examen Final Quimica Bioinorgánica
El miércoles tengo un examen profesional de 16:00 hrs en adelante, así que no me será posible darles clase.
La fecha del examen final está marcada el día Viernes 11 de Mayo de 18:00 a 20:00 hrs.
Les pido por favor que nos veamos el jueves 10 y el viernes 11 de mayo, a las 5 de la tarde en la sala de juntas (el salon donde siempre hemos tenido clase) para las presentaciones. Previo a ello, el miércoles 9 de mayo deberé haber recibido sus trabajos impresos y bien fundamentandos para poder calificarlos previo a las presentaciones. Tendrán un máximo de 30 minutos y un mínimo de 15 minutos para hablar sobre el tema que les haya correspondido, y responder a las preguntas de sus compañeros y mías.
Suerte.
Fecha de examenes (reposicion, final, etc).
La fecha de examen de reposición (examen 1 o 2) será este jueves 3 de Mayo a las 16:00 en un salón por definir (ver en pizarra de avisos del departamento). Para aquellos que pueden tomarlo por la mañana, estaré a las 8:30 en el salón de clase para aplicarles el examen.
El examen final será, de acuerdo al calendario de examenes, el jueves 17 de Mayo de 8:00 a 10:00 en el CS-104. Para evitar conflictos, traslapes y problemas, esa será la fecha en que haremos el examen (then, forget about May 8).
Esta información también estará posteada en el portafolios (http://portafolios.udlap.mx/profesores/miguela.mendez/quimicageneral/default.aspx) para mayor información.
Saludos.
Algo sobre elementos
Nombres de elementos en honor a planetas y asteroides:
Mercurio, su nombre se debe al planeta del mismo nombre, pero su abreviatura es Hg. Dioscórides lo llamaba plata acuática (en griego hydrárgyros). hydra=agua, gyros= plata.
Uranio (U): del planeta Urano.
Neptunio (Np): del planeta Neptuno.
Plutonio (Pu): del planeta Plutón.
Cerio (Ce): por el asteroide Ceres, descubierto dos años antes. (¿Sabíais que el cerio metálico se encuentra principalmente en una aleación de hierro que se utiliza en las piedras de los encendedores?).
Titanio(Ti): de los Titanes, los primeros hijos de la Tierra según la mitología griega.
Nombres de lugares y similares:
Magnesio (Mg): de Magnesia, comarca de Tesalia (Grecia).
Scandio (Sc) Scandia, Escandinavia ( por cierto, Vanadio (V): Vanadis, diosa escandinava).
Cobre (Cu): cuprum, de la isla de Chipre.
Galio (Ga): de Gallia, Francia.
Germanio(Ge): de Germania, Alemania.
Nombres que hacen referencia a propiedades:
Berilio (Be) de beriio, esmeralda de color verde.
Hidrógneno (H): engendrador de agua.
Nitrógeno (N). engendrador de nitratos (nitrum)
Oxígeno (O): formador de ácidos (oxys)
Cloro (Cl) del griego chloros (amarilio verdoso).
Checa más de estos datos en: http://www.uv.es/~jaguilar/elementos/nombres.html
Sunday, April 29, 2007
Sólo una curiosidad...

Número atómico: 82
Valencia: 2,4
Estado de oxidación: +2
Electronegatividad: 1,9
Radio covalente (Å): 1,47
Radio iónico (Å): 1,20
Radio atómico (Å): 1,75
Configuración: [Xe]4f145d106s26p2
Masa atómica (g/mol): 207,19
Densidad (g/ml): 11,4
Punto de ebullición (ºC): 1725
Punto de fusión (ºC): 327,4
Descubridor: Los antiguos
El Plomo, Pb, es de color azuloso, que al empañarse adquiere un color gris mate, es flexible, inelástico, se funde a 327.4ºC (621.3ºF) y hierve a 1725ºC (3164ºF). Además, es relativamente resistente al ataque de los ácidos sulfúrico y clorhídrico, pero se disuelve con lentitud en ácido nítrico. Es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico. El plomo forma muchas sales, óxidos y compuestos organometálicos.
Sus compuestos más importantes son los óxidos de plomo y el tetraetilo de plomo. El plomo forma aleaciones con muchos metales y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Todas las aleaciones formadas con Sn, Cu, As, Sb, Bi, Cd y Na tienen importancia industrial. No obstante, sus compuestos son tóxicos y llegan a producir envenenamiento en trabajadores.
El Pb raras veces se encuentra en estado natural, el mineral más común es el sulfuro y la galeana. Asimismo, se encuentra Pb en varios minerales de uranio y de torio, ya que proviene directamente de la desintegración radiactiva.
Dentro del uso del mismo se encuentra la fabricación de acumuladores. Otras aplicaciones importantes son la fabricación de tetraetilplomo, forros para cables, elementos de construcción, pigmentos, soldadura suave y municiones.
Gracias a su resistencia a la corrosión, el Pb encuentra un amplio uso en la construcción, en particular en la industria química. Es resistente al ataque por parte de muchos ácidos, porque forma su propio revestimiento protector de óxido. Como consecuencia de esta característica, el Pb se utiliza mucho en la fabricación y el manejo del ácido sulfúrico.
Información de Water purification & Air Treatment – Lenntech. 2006.
Fotografía de Euroresidentes, 2004.
Nicotina para todos
Las vieron pasar
Debido a su escala, no es tan fácil observar los fenómenos que ocurren a nivel molecular. Sin embargo, científicos del Imperial College de Londres desarrollaron una nieva técnica para observar en moléculas de hidrógeno y metano, el movimiento de los protones, piezas fundamentales de los átomos. Para conseguirlo, dispararon un pulso láser corto pero potene hacua una molécula, el cual ocasionó que se desprendiera un electrón, dejándola en un estado de excitación ionizado. Al regresar el electrón y coalisionarse, pronvocó una corta emisión de rayos X. Seguro que nos tardamos más tiempo en leer la descripción del experimento que lo duró en realidad: 100 attosegundos (10-18 segundos, es decir, 0.000 000 000 000 000 001 segundos). Se trata de la observación más rápida resgistrada en este tipo de fenómeno. Los investigadores mencionan que el estudio nos permitirán comprender cómo ocurren los procesos químicos y biológicos, que podrían ser utilizados en el desarrollo de futuras tecnologías,como la computación a nivel cuántico.
¡Qué Boquita!
Es bueno enjuagarse la boca para acabar con los microorganismos que causan el mal aliento. Al hacerlo, sin embargo, también mueren otras bacterias que componen la flora interior de nuestra boca, y esto puede provocar otro tipo de infecciones. Para atacar este problema, investigadores de laUniversidad de California en Los Ángeles (UCLA) desarrollaron una nueva clase de móleculas ‘inteligentes’ que seleccionan a las bacterias nocivas, las eliminan y dejan intactas al resto. Estas moléculas, bautizadas como Péptidos antimicrobianos específicamente seleccionados (STAMP por sus siglas en inglés),sólo atacan a bacterias comunes.
Micropaquetería
Algodón comestible
Friday, April 27, 2007
"chistes!
1. COMENZANDO POR 10. Encontrar el nombre de un elemento químico que empiece por 10, y que no sea IODO.
2. Si no eres parte de la solución, eres parte del precipitado.
3. Los radicales libres han revolucionado la química.
4. ALQUIMIA. Tome un elemento químico, quítele su respectivo símbolo y quedará convertido en oro.
5. Para la mayoría de la gente, una solución es una respuesta. Para los químicos no es más que agua sucia.
6. Un profesor de química que tenía un ojo de cristal cuando señalaba a alguien con el dedo se levantaba toda la fila porque no se sabia a quien miraba. Le llamaban "el antimonito" por aquello de la formula Sb2O3 (ese ve dos o tres).
7. TRES AL SERVICIO. Si entran dos señores, uno de ellos químico en un servicio a hacer pipí, ¿cómo se sabe cuál es el químico?
8. Lo peor de ser químico es que te pasas el día rodeado de botellas pero no puedes beber de ninguna.
9. Un científico muy importante de la Pontificia Universidad Científica de la Hermana República de Chavinda descubrió un antídoto contra el SIDA. El nitrato de metilo.
10. 1+1=1. ¿Cómo demostrar experimentalmente que 1+1=1?
Nanotecnologia en alimentos
El instituto de ciencia y tecnología de los alimentos (IFST) del Reino Unido reclama cautela ante la introducción de las nanotecnologías en los alimentos, argumentando que se debe garantizar a los consumidores que cualquiera de estos avances es necesario y seguro.
En una declaración de información sobre el uso de la nanotecnología en la industria alimentaria, publicado el 14 de febrero, IFST afirma que la mayoría de las principales empresas alimentarias siguen con interés los beneficios potenciales de las nanociencias. Kraft Foods fue la primera empresa en fundar un laboratorio de nanotecnología en 1999, mientras que Unilever y Nestlè cuentan con investigadores que estudian el uso de la nanotecnología en los alimentos.
De hecho, un estudio elaborado por Helmut Kaiser Consultancy en 2004 informó que había más de 180 aplicaciones nanotecnológicas para la industria de alimentos en varias fases de desarrollo y que el número de solicitudes de patentes en este campo crece rápidamente. El valor del sector podría ascender a unos 20.000 millones de dólares estadounidenses, según reveló el estudio.
"Para la mayoría de estas aplicaciones, las preocupaciones relativas a la seguridad parecen ser insignificantes", informa la declaración de IFST, añadiendo que muchos métodos tradicionales de elaboración de alimentos cocinados se basan en la modificación de nanoestructuras que ocurren de forma natural. No hay actualmente pruebas suficientes que den alguna pista sobre si las nuevas aplicaciones de nanotecnología en los alimentos serán bien acogidas por los consumidores, sin embargo, la experiencia con alimentos modificados genéticamente demuestra que convencer a la gente de las excelencias de la tecnología de alimentos que no son comprendidas por completo podría suponer un reto considerable.
"La mayor preocupación potencial se centra en torno a la posible ingestión de nanopartículas libres", afirma la declaración. "Ello se debe en parte al pequeño tamaño de las partículas, que les permitiría llegar a regiones dentro de las células o los tejidos normalmente inalcanzables para las partículas macroscópicas de la misma composición. Por lo tanto, es posible que sean inadecuadas las pruebas convencionales sobre toxicidad.
Como conclusión, el IFST cree necesario considerar las nanopartículas como nuevos materiales potencialmente dañinos que requieren de pruebas rigurosas de seguridad. Los datos toxicológicos y sobre seguridad presentados para respaldar las solicitudes de autorización deben estar abiertos a la revisión paritaria pública, y los borradores de opinión elaborados por las autoridades de autorización deben ser también de dominio público. Por último, la elección de los consumidores y su seguridad podrían mejorarse con la introducción de disposiciones adecuadas sobre trazabilidad y etiquetado, concluye la declaración.
Para leer la declaración completa del IFST, visitar:
http://www.ifst.org/hottop45.htm
Descubren un componente natural de la sangre humana que bloquea el VIH
Crean vaca transgénica que produce insulina
Descubren propiedades medicinales en el tequila
El desarrollo podría conducir a tratamientos mejorados para la colitis ulcerativa, síndrome irritable del intestino, cáncer, la enfermedad de Crohn y otras enfermedades del colon. La entrega de medicamentos en el colon ha sido un desafío para los médicos.
Muchas drogas son destruidas por los ácidos del estómago antes de que hayan tenido una ocasión de alcanzar el intestino, donde se absorben generalmente.
Los investigadores han intentado evitar este problema insertando las drogas en moléculas portadoras que resisten su colapso en el estómago, pero han tenido dificultad para encontrar un compuesto conveniente para el portador.
Los compuestos del tequila, una clase de los polisacáridos conocidos como fructans, fueron desarrollados por científicos en México, en microesferas minúsculas que son capaces de llevar las drogas existentes que se utilizan para tratar enfermedades del colon.
Como los compuestos resisten la destrucción en el estómago, podrían permitir que más drogas alcancen el colon intacto, mejorando su eficacia, afirman los investigadores. Su estudio fue presentado en la 233 reunión nacional de la sociedad química americana.
"Este estudio demuestra que la fruta del agave es buena no sólo para el tequila. También tiene valor medicinal", dice Guillermo Toriz, profesor auxiliar en la universidad de Guadalajara, y quien encabezó el estudio.
"El fructan del Agave es el portador natural ideal de medicamentos para el colon".
Los investigadores han sabido desde hace tiempo que los fructans, que son polímeros de la fructosa, son resistentes a la degradación ácida y teóricamente podrían ser un vehículo útil en la entrega de medicamentos.
Pero solamente algunos plantas, tales como el agave, contienen fructans en grandes cantidades.
La fruta del agave es fructans en un 80 por ciento cuando es madura, señalan los investigadores. Toriz y sus colegas extrajeron fructans del agave azul, el ingrediente base del tequila.
Químicamente modificaron el compuesto de fructan para permitir que las drogas sean encapsuladas, haciéndolas resistentes a la degradación en el sistema digestivo.
Las microesferas entonces son preparadas por los investigadores del compuestos y llenadas con ibuprofen como modelo de entrega de la droga en el colon.
En pruebas de laboratorio, las microesferas llenadas de ibuprofen, fueron expuestas al ácido clórhidrico por una hora, permaneciendo físicamente intactas tras su examinación microscópica subsecuente.
Topiz y su grupo de investigación están trabajando actualmente en mejorar la durabilidad de los fructans y planean estudios futuros en animales.
Si otros estudios demuestran ser también prometedores, se anticipan estudios de las microesferas de agave en humanos.
El financiamiento para el estudio fue proporcionado por el Consejo Nacional Mexicano de Ciencia y Tecnología.
Uranio Mexicano

Existe allá, por algún lugar de Veracruz, la central Nucleoeléctrica de Laguna Verde, está dividida en dos unidades y cada una tiene una capacidad de producción de 654 MWe (Mega Watts Eléctricos), por tanto su principal función es la producción de electricidad y genera el 2% del consumo nacional de electricidad. Para hacerlo, primero la energía del combustible (el uranio) se utiliza para producir vapor de presión y temperatura elevadas, ésta energía se transforma para realizar el movimiento de una turbina, su giro se transmite a un generador para la producción de electricidad.
Para usar uranio, se requiere que este se encuentre en forma de uranio metálico o como óxido de uranio. Para contenerlo, se requieren de cápsulas especiales. Después, para la generación de energía se hace uso de la fusión, donde el neutrón que va producir la fusión requiere de una velocidad del orden de 2 km/seg.
El uranio resulta ser entonces de gran importancia para la generación de energía por lo que en un futuro no muy lejano, muchas de las centrales energéticas dependerán de este elemento tan demandado por sus propiedades químicas. Otro potencial uso de uranio se da para la construcción de armamento nuclear, con lo que logra ser participe de muchas disputas entre los países desarrollados. A la fecha, los principales países productores de uranio son: Canadá, Australia, Kazakhstan, Nigeria, Rusia, Namibia, Uzbekistán, Estados Unidos, Ucrania, África del Sur y China.
En México se cuanta con innumerable recursos minerales que bien pueden beneficiar de gran manera al desarrollo del país. Contamos con fuentes de energía que desgraciadamente se desaprovechan o no se han sabido dirigir quizás por cuestiones económicas o políticas.
Thursday, April 26, 2007
Nano-sensores químicos
Según el profesor, los nanomateriales se ajustan bien a las aplicaciones de sensores químicas, porque sus propiedades químicas varían bastante en respuesta a los cambios que ocurren en su entorno químico. Como se pueden fabricar los nanomateriales de estructuras de unos cuantos atomos, solo unas cuantas moléculas de química pueden provocar una reacción. Osterloh y su equipo han descubierto que nanocables hechos con átomos de litio, molibdeno y selenio producen cambios en la resistencia eléctrica de hasta 200 por ciento al ser expuestos a vapores de solventes orgánicos. Cuando se depositan los nanocables entre dos conductores, se forma un sencillo sensor químico.
Al agregar grupos químicos a los nanocables, los investigadores pudieron modificar el sensor para medir la acidez de una solución. Actualmente el equipo investiga si esta propiedad “programadora” se podrá extender para hacer factible el uso de sensores para detectar explosivos u otros peligros como contaminación medioambiental.
Sustituyen madera por nanopolimero
en el periodico la jornada encontre un articulo muy interesante trata acerca de un polimero nanocompuesto que diseñaron especialistas del Instituto de de investigaciones en materiales de la UNAM, el cual puede sustituir e incluso mejorar las propiedades de la madera.
este desarrollo tecnologico ya esta siendo utilizado por empresas mexicanas, y la que siento qeu es l omas importante es que gracias a materiales como este que se pueden obtener del petroleo ya no es necesario explotar blosques. los nanopolimeros tambien pueden servir como plasticos y en especial se hace referencia al pvcya que estos son mas resistentes a la corrosion y a la temperatura.
el equipo que los diseño esta formado por los doctores Antonio Sanchez Solis y Arturo Manero Brito, el trabajo de investigacion duro 5 años.
Con este trabajo el instituto registro 2 patentes la referida al accesorio para la fabricacion y el metodo de produccion.
Wednesday, April 25, 2007
Laboratorio Casero
Pequeñas Soluciones
Casi transparente
Gelatina
La gelatina que conocemos comúnmente posee ciertas características distintas a la mayoría de las sustancias con las que tenemos contacto en nuestra vida diaria. La capacidad de solidificarse a temperaturas no muy bajas, su flexibilidad, viscosidad, etcétera. Solo son el reflejo de interacciones a nivel molecular. De las que hablaremos a continuación.
La gelatina es una sustancia derivada del colágeno, una sustancia que constituye gran parte del tejido conectivo en los seres vivos. El colágeno es una molécula de naturaleza proteica, es decir que esta formada en base a aminoácidos. Esta formada por 3 cadenas de aminoácidos, también llamados monómeros de tropocolágeno enlazados en forma de hélice. Esto debido a los enlaces de hidrogeno que se encuentran dentro de las cadenas. Debido a la forma de esta molécula, estas fibras se disponen de manera ordenada y unida unas a otras. Brindando resistencia y flexibilidad principalmente al tejido conectivo de los animales.
Triple hélice de tropocolágenoAl romper los enlaces de hidrogeno que forman las hélices dentro de la molécula de colágeno, por diversos métodos, se forman tres nuevos tipos de cadenas de diferentes pesos moleculares. Puesto que las uniones entre las cadenas ya no dependen del enlace de hidrogeno, se forman cadenas de manera aleatoria, a partir de los enlaces que se puedan formar entre los grupos terminales de las cadenas de aminoácidos. La diferencia entre los pesos de las cadenas determinan la viscosidad, adherencia y dispersabilidad en el agua de las gelatinas. Por ejemplo, cuando hay más cadenas de un peso molecular menor, la viscosidad disminuye.
Al ser una molécula soluble en agua, la gelatina forma un coloide lo que también la hace adquirir ciertas propiedades como la capacidad de formar coágulos.
Un coloide es una suspensión compuesta de dos fases la continua que forma el fluido y otra dispersa que se compone de partículas sólidas que no pueden verse a simple vista pero que a nivel molecular son grandes con respecto a otras moléculas.
Referencias
http://es.wikipedia.org/wiki/Colágeno
http://es.encarta.msn.com/encyclopedia_761555673/Coloide.html
Bacterias en nuestro intestino podrían ser importantes causantes de la obesidad .
En el intestino se encuentran dos grupos de bacterias que son beneficiosas al organismo porqué ayudan a disgregar los alimentos, las bacterioidetes y las firmicutes.
Las proporciones se incrementan cuando las personas obesas hacen dieta. Una posible explicación la encontró un grupo que trabajó con ratones en laboratorio al incentivar la flora intestinal en los animales con sobrepeso a los normales, se observó que éstos aumentaban su materia grasa en su cuerpo y de ahí se supone que tenga influencia en el peso corporal de una persona.
Estas bacterias en nuestro intestino tienen gran importancia en la regulación del peso como el sedentarismo que lo aumenta junto con el exceso de calorías, de ahí que controlando la composición bacteriana en el intestino puede ser de gran utilidad para controlar la obesidad y grasa abdominal profunda. Sin embargo todavía no está claro si las pequeñas diferencias en aprovechar los alimentos son las responsables de hacer la gran diferencia en el peso del cuerpo. Considerando que las personas que sufren problemas de obesidad estaban controladas con bacterias al comenzar la dieta y aquellos que eran obesos tenían menores niveles de bacteroidetes y mayor número de firmicutes que los voluntarios delgados. A medida que iban perdiendo peso la cantidad de bacteroidetes crecía independiente de la dieta que se les hacía.
Cada vez hay más evidencias obtenidas para demostrar que la obesidad no solo se trata de estar comiendo demás y no hacer ejercicio físico ya que existe la "obesidad infecciosa" como una enfermedad provocada por múltiples causas, ya sea por virus o microbios.
Es probable que en la próxima década existan otros tratamientos alternativos para tratar los diferentes tipos de obesidad que puedan descubrirse.
Por ahora el comer saludablemente y el hacer ejercicio seguirán siendo la mejor forma de controlar los firmicutes y las bacterioidetes… por lo menos por un tiempo
Descubrimiento de la regulación de un proceso genético que sintetiza las proteínas.
Alberto Kornblithtt y Manuel de la Mota ambos argentinos, integrantes del Laboratorio de Fisiología y Biología Molecular de la Facultad de Ciencias Exactas y Naturales de la UBA y del Conicet, lograron determinar el mecanismo que se conoce como Splicing alternativo.
El gen estudiado por el dúo científico fabricó 20 proteínas pero hay otros que producen centenares o miles de proteínas diferentes.
Los genes ADN están estructurados como "exones" y otros llamados "intrones" y para un primer paso sintetizar la proteína, la enzima polimerasa II copia al gen y fabrica un ARN mensajero que al eliminar los intrones pre mensajeros, los exones se unen entre sí, así un exón 1 se une con el 2 y éste con el 3, pero por el splicing alternativo hace que el exón 1 se una con el 3 y salteé el 2, que en ésta variación permite producir más de una proteína.
Con el desarrollo de la ingeniería genética por De la Mota consiguió eliminar la colita que tiene la enzima llamada dominio carboxilo terminal y se consiguió que la Pol II copie al gen con colita o sin ella, pero si la tiene se excluyen los exones y cuándo no está, quedan incluídos. Ésto ocurre porquè la enzima Pol II se pega a una proteína inhibidora, la SRp20 y al copiarse saltéa los exones. y al no estar la no inhibición el gen se transcribe tal cuál y su comprobación se logró sencillamente.
Con éste trabajo todavía no existe cura para ninguna enfermedad, pero se obtienen conocimientos para entender mejor como es el funcionamiento de las células y como obtener las mejores alternativas terapéuticas de tratamiento que interese a la biología de todo el mundo.
La ciencia argentina ha demostrado su capacidad y tenacidad investigadora y con el trabajo ha permitido avanzar a pesar de los pocos recursos económicos con que cuenta. Para hacerla competitiva hace falta más dinero para la investigación y éste trabajo fué financiado por la UBA, Conicet, Antorchas, Howard Hughes Medical Institute y Eurasnet.
Tuesday, April 24, 2007
Celulas Solares Plasticas

En la imagen se muestran nanocables para capturar energía solar. Los nanocables son cables de 1nm de grosor. Se trata de estructuras moleculares con propiedades eléctricas u ópticas, cuyo uso depende de su composición química. En este caso se trata de nanocables para capturar la energía del sol.
Monday, April 23, 2007
Falsificaciones de luna
Para esto del ISRU y otras investigaciones sobre el diseño de vehículos lunares, no les alanza latiera lunar, por eso necesitan producir un suelo lunar de alta calidad, según explica Larry Taylor, director del Instituto de Geociencias Planetarias de la Universidad de Tennessee, en Knoxville. David S. McKay, jefe científico para temas astrobiológicos del Centro Espacial Johnson (JSC) señala que necesitan mas que unas cuantas bolsitas de tieera lunar, necesitan toneladas, sobretodo para eñ desarrollo de tecnología de excavadoras, ruedas y maquinaria de superficie. Ellos, autoproclamados ‘lunáticos’, cuyas carreras científicas se han centrado en el estudio del suelo y de las rocas lunares, uuuyyy que divertido, forman parte del equipo de consultores del Centro Marshall de Vuelos Espaciales que dirige el Programa de Desarrollo de Sucedáneos de Regolito Lunar. Carole McLemore, responsable del programa en el MSFC, explica que en los 90, se usaba un sucedáneo lunar llamado JSC-1, desarrollado en el JSC, pero ya se acabó. Ahora como iniciativa los científicos del MSFC están trabajando con la oficina de Investigación de Astromateriales y Exploraciones Científicas del JSC para producir una réplica del sucedáneo JSC-1: el JSC-1ª.
Hasta ates que el Apolo trajera muestras del suelo lunar, se creía que el ambiente seco y sin aire de la Luna mantenía el suelo prácticamente inalterado en realidad es mucho más complicado. Micrometeoritos, la mayoría más pequeños que la punta de un lápiz, caen constantemente como de lluvia sobre la superficie a velocidades de hasta 100.000 km/h lo que desgasta el material de la superficie o forma cráteres de impacto microscópicos. Algunos funden el suelo y se vaporizan, para recondensarse en forma de capas vidriosas sobre otras partículas de polvo, también se sueldan las partículas del suelo, formando conglomerados, que después con el viento solar convierten el hierro del suelo en millones de partículas de hierro metálico nanofásico, de apenas unos pocos nanómetros de diámetro. Estos procesos generan el regolito, capa externa la superficie de la Luna, según Taylor, es un material formado por "esquirlas y fragmentos aglomerados de vidrio, afilados, abrasivos y frágiles", este restriega la maquinaria y las juntas, y daña los pulmones humanos. "Parte del material que ingresó en la nave Apolo era polvo muy fino", dijo McKay. A finales de los 80, el renovado interés por las exploraciones lunares hizo que se necesitaran imitaciones de suelo lunar para probar estrategias de construcción de estructuras en la Luna o de extracción de oxígeno y otros materiales. Lo que llevó al desarrollo del JSC-1 en 1993, hecho de escoria basáltica el lote de 25 toneladas, distribuido en bolsas de 25 kilogramos, tuvo mucho éxito.
Estos procesos generan el regolito, capa externa la superficie de la Luna, según Taylor, es un material formado por "esquirlas y fragmentos aglomerados de vidrio, afilados, abrasivos y frágiles", este restriega la maquinaria y las juntas, y daña los pulmones humanos. "Parte del material que ingresó en la nave Apolo era polvo muy fino", dijo McKay. A finales de los 80, el renovado interés por las exploraciones lunares hizo que se necesitaran imitaciones de suelo lunar para probar estrategias de construcción de estructuras en la Luna o de extracción de oxígeno y otros materiales. Lo que llevó al desarrollo del JSC-1 en 1993, hecho de escoria basáltica el lote de 25 toneladas, distribuido en bolsas de 25 kilogramos, tuvo mucho éxito.
McKay. Señaló que todo cambiará, ya que el MSFC ha firmado un contrato de Investigación Innovadora en Pequeñas Empresas con Orbitec, para producir 16 toneladas métricas de los tres tipos de JSC-1A: 1 tonelada de grano fino, 14 de mediano y una de grueso.
El MSFC está desarrollando tres nuevos sucedáneos de suelo lunar, dos imitan el material de los mares lunares y las regiones montañosas de los polos, el tercero simula los bordes vidriosos, afilados y dentados del regolito que se usará para poner a prueba la maquinaria y a los humanos en las condiciones más extremas. No obstante, para recrear el material de cada zona de la Luna haría falta producir un gran número de pequeños, únicos y costosos lotes de sucedáneos."En vez de eso, desarrollaremos sucedáneos básicos, produciremos otros más específicos a partir de ellos, y también permitiremos que los investigadores mejoren los productos según sus necesidades" explica McLemore, todo se basa en encontrar la “receta" fundamental para hacer buenas imitaciones de suelo lunar. La nueva imitación del suelo de los mares lunares estará enriquecida con ilmenita, un óxido cristalino de hierro y titanio. Los primeros lotes serán sólo de unas decenas de kilogramos, hasta que pueda comprobarse que las imitaciones están bien hechas, se aumentará la producción cuando se estandarice el producto final, con lo que se contratará otras subsidiarias para satisfacer la demanda. Creo que todo esto seguirá hasta que se den cuenta de que ya tienen más de lo necesario, pero bueno que se diviertan estudiando rocas.
Pico en el ciclo solar
 Según datos de la NASA de 50 años de mediciones de la actividad geomagnética y de la actividad solar, un ciclo con un pico alto se acerca. El físico solar David Hathway, del Centro Marshall de Vuelos Espaciales predice que este pico sera en el ciclo solar número 24, que se producirá en 2010 o 2011, "parece ser uno de los ciclos más intensos que se hayan registrado, desde que estos se comenzaron a documentar hace casi 400 años", junto con su colega Robert Wilson presentaron esta conclusión en el encuentro de la Unión Geofísica Americana.
Según datos de la NASA de 50 años de mediciones de la actividad geomagnética y de la actividad solar, un ciclo con un pico alto se acerca. El físico solar David Hathway, del Centro Marshall de Vuelos Espaciales predice que este pico sera en el ciclo solar número 24, que se producirá en 2010 o 2011, "parece ser uno de los ciclos más intensos que se hayan registrado, desde que estos se comenzaron a documentar hace casi 400 años", junto con su colega Robert Wilson presentaron esta conclusión en el encuentro de la Unión Geofísica Americana.Básicamente esta predicción se basa en los registros que se han recolectado sobre las tormentas geomagnéticas. Cuando un viento solar choca con el campo magnético de la Tierra, hace que este se sacuda, cuando esto es intenso se le conoce como tormenta geomagnética, estas ocasionan que las agujas de brújulas oscilen y no apunten en la dirección correcta, y yo que siempre llevo una para no perderme, así como apagones eléctricos y un bonito efecto que son las auroras boreales.
De acuerdo a las investigaciones de Hathaway y Wilson se observa que los registros de actividad geomagnética se remontaban a casi 150 años, notando que con los registros actuales de actividad geomagnética se puede establecer el comportamiento ciclo solar dentro de 6 a 8 años, como se muestra en la gráfica:
En la gráfica las curvas negras son los ciclos solares; la amplitud es el número de manchas solares, las curvas rojas son los índices geomagnéticos, específicamente el Índice de Variabilidad Inter – Horaria (IHV). Estos índices derivan de datos registrados en magnetómetros colocados uno en Inglaterra y el otro en Australia. Los datos del IHV han sido tomados todos los días desde 1868" .
Los científicos no conocen la física detrás de estas predicciones en base al IHV, pero predice la amplitud del ciclo solar para un periodo superior a 6 años con una correlación del 94%.
De acuerdo con el análisis, el próximo Máximo Solar podría alcanzar su pico de intensidad alrededor del año 2010 con un número de manchas solares de 160 más o menos 25.
Estos resultados son sólo las últimas señales que indican un gran Ciclo Solar 24, pero una aún más interesante aproximación para este fenómeno es el trabajo de Mausumi Dikpati y colegas del Centro Nacional de Investigaciones Atmosféricas, quienes han combinado observaciones de la ‘banda transportadora’ solar con un sofisticado modelo computacional del dinamo interno del Sol con el fin de predecir el próximo ciclo solar, lo que en otras palabras es que tratan de elaborar un modelos más preciso tomando como base la física. Preparados para el ciclo solar, y será interesante observar como afectará la tecnoogía que tenemos.
OJO!! con las almendras
Fumar y la cafeína pueden proteger de la enfermedad de Parkinson
Ya existían estudios anteriores que sugerían esta posibilidad, sin embargo, ésta es la primera vez que se observa específicamente el consumo de cafeína y cigarrillos en las familias afectadas por la enfermedad, dicen los investigadores. El estudio se realizó en 356 pacientes de Parkinson y 317 familiares sin la enfermedad.
Los individuos con la enfermedad de Parkinson tienen la mitad de probabilidad de haber fumado alguna vez y un tercio de probabilidades de fumar actualmente comparados con los parientes no afectados, según encontraron los investigadores. De todos modos, el mecanismo biológico a través del cual podrían trabajar los cigarrillos y la cafeína en los individuos con riesgo de Parkinson aún no está claro.
Pese al descubrimiento, y como es lógico, fumar cigarrillos y consumir copiosas cantidades de cafeína conlleva sus propios riesgos y no debería tomarse como un intento de evitar el desarrollo de la enfermedad de Parkinson, advierte el investigador del estudio y Profesor asociado de medicina Burton L. Scott.
Sunday, April 22, 2007
El futuro del sector quimico esta repleto de desafios
Según previsiones de la Federación Empresarial de la Industria Química Española (Feique), este año 2006, y tomando un escenario en el que el precio del crudo se estabilice en el entorno de los 56 dólares, y la fluctuación euro/dólar se mantenga en un margen de 1,25 a 1,30 dólares por euro, el crecimiento del valor de producción previsto para el sector químico español es del 2,8 por ciento, si bien y al contrario de lo ocurrido en 2005, será un incremento alimentado por el crecimiento en volumen, mientras que los precios sufrirán un retroceso de dos décimas.
Sin embargo, si se tiene en cuenta la coyuntura internacional y la presión competitiva de los países asiáticos, con China a la cabeza, y de Estados Unidos, el futuro del sector químico, tanto a nivel español como europeo, presenta un horizonte lleno de desafíos que obliga a articular urgentemente una política industrial efectiva o, cuanto menos, a no desarrollar iniciativas lesivas cuando no arbitrarias para poder aprovechar la capacidad de crecimiento del sector y poder competir en igualdad de condiciones.
El sector químico sigue consolidándose como el segundo mayor exportador de la economía española tras la automoción
2005 ha sido un buen año
El comportamiento del sector en 2005 ha estado fuertemente condicionado por el intenso crecimiento del precio del crudo, que ha provocado que sean los precios y no el volumen los que impulsen el valor de producción. Así, al cierre del ejercicio, el sector ha registrado un crecimiento del 5,8 por ciento, que sitúa el valor de producción por encima de los 35.900 millones de euros, es decir, 2.000 millones de euros más que en 2004.
Este incremento se debe fundamentalmente al crecimiento de los precios (+5,5 puntos) y no al volumen (que sólo aumenta tres décimas), y ha estado alimentado por una todavía potente demanda interna y por la capacidad de internacionalización de las empresas.
En el caso de la demanda, el consumo de productos químicos en el mercado español concluyó el año 2005 con un incremento del 6,7 por ciento para superar los 45.300 millones de euros, un crecimiento que ha sido capaz de absorber el incremento de los precios de nuestra producción.
El segundo factor determinante ha sido el excelente comportamiento de nuestras empresas en el exterior, ya que el valor de las exportaciones se elevó desde los 15.919 millones de euros en 2004 a más de 17.600 en 2005, registrando por tanto un crecimiento del 10,7 por ciento. En este caso cabe destacar que los componentes volumen y precios crecieron simultáneamente, lo que provoca este buen comportamiento.
Cabe destacar que con este resultado el sector químico seguirá consolidándose como el segundo mayor exportador de la economía española tras la automoción, y que continuará dedicando a mercados exteriores casi la mitad de la producción.
Por su parte, las importaciones crecieron unas décimas por debajo de las exportaciones, lo que contribuyó a mejorar la balanza comercial del sector, situando el índice de cobertura de exportaciones sobre importaciones por encima de 65 por ciento
Promover el hidrogeno, vector de energia limpia entre los cuidadanos
En el marco del rally que pretende demostrar los resultados de estos vehículos respetuosos con el medio ambiente, Air Liquide puso en funcionamiento dos estaciones de servicio, concebidas y desarrolladas por el Grupo, que alimentaron los vehículos de hidrógeno en el centro de pruebas del CERAM del 8 al 10 de Junio y en Champ de Mars próximo a la torre Eiffel el 11 de Junio.
El hidrógeno vector de energía es una solución alternativa prometedora tanto en el aspecto medio ambiental, como desde un punto de vista económico. Utilizado en una pila de combustible, el hidrógeno se combina con el oxígeno del aire para producir electricidad y como único residuo agua. El hidrógeno puede ser extraído de un gran número de materias primas (gas natural, carbón, agua más electricidad e incluso biomasa...). Aunque hoy el 95 por ciento del hidrógeno se produce a partir del gas natural, la multiplicidad de fuentes de producción garantiza una seguridad de aprovisionamiento.
Apoyándose en las tecnologías de Air Liquide, las estaciones de servicio de distribución de hidrógeno cuentan con un dispositivo de distribución rápida del hidrógeno a alta presión (700 bar y 350 bar) en el depósito, que permite garantizar una seguridad total del conductor y del vehículo. Estas estaciones permiten así repostar en 3 minutos con una facilidad similar a la que nos encontramos con un carburante clásico, y recorrer varios centenares de kilómetros. Así el Grupo ha concebido y realizado 7 estaciones de servicio de distribución de hidrógeno en el mundo durante los cuatro últimos años en: Madrid, Kawasaki, Luxemburgo, Singapur, una estación móvil en Shangai, otra para una empresa de construcción de automóviles europea y la estación de demostración de Sassenage (cerca de Grenoble en Francia) donde está implantada su filial Axane que inventa, desarrolla y comercializa pilas de combustible.
Teoría del flogisto
J. J. Becher concibió dicha teoría a finales del siglo XVII, si bien el responsable de su difusión y popularización fue Georg Ernst Stahl, quien aseveraba que la herrumbre del metal era el resultado de un proceso de combustión. La teoría afirma que todos los materiales inflamables contienen flogisto (sustantivo derivado del griego phlogistos, que significa "inflamable"), una sustancia incolora, inodora, insípida y desprovista de peso que se libera durante la combustión. Tras haber ardido, la sustancia "desflogisticada" adquiriría su forma "verdadera", convirtiéndose en cal.
La teoría recuerda en cierta medida a la noción de la alquimia conforme a la que el fuego es uno de los cuatro elementos (el agua, el aire y la tierra constituirían los otros tres) que contiene una sustancia.
Las sustancias "flogisticadas" son aquéllas que contienen flogisto y, al arder, quedan "desflogisticadas". Dado que se había observado que cualquier sustancia arde durante un periodo limitado si la cantidad de aire disponible es igualmente limitada (en caso de hallarse, por ejemplo, en un recipiente estanco), se pensaba que el aire albergaba una cantidad específica de flogisto. Por ello, al residuo de aire que quedaba tras el proceso de combustión (en realidad, una mezcla de nitrógeno y dióxido de carbono), se le solía denominar "aire flogisticado", pues se pensaba que durante la combustión dicho aire había absorbido todo el flogisto. Así pues, cuando se descubrió la existencia del oxígeno, se pensó que éste sería "aire desflogisticado" capaz de combinarse con una cantidad mayor de flogisto y, de este modo, fomentar la combustión.
Finalmente, determinados experimentos pusieron de manifiesto ciertas contradicciones. Valga mencionar entre éstas el que algunos metales ganaran peso al arder en lugar de perderlo, como sería de esperar, dado que, teóricamente, la combustión significa la pérdida flogisto. No obstante, la referida al flogisto siguió siendo la teoría dominante hasta que Antoine Lavoisier demostró que la combustión requiere oxígeno, lo que resolvió la paradoja de la pérdida de peso y supuso el inicio de una nueva teoría referida a la combustión.
Friday, April 20, 2007
¿Apoyo a la ciencia?
Pero, ¿qué son los alimentos trnasgénicos?
Según Greenpeace:
Un transgénico (u Organismo Modificado Genéticamente, OMG) es un organismo vivo que ha sido creado artificialmente manipulando sus genes. Las técnicas de ingeniería genética consisten en aislar segmentos del ADN (el material genético) de un ser vivo (virus, bacteria, vegetal, animal e incluso humano) para introducirlos en el material hereditario de otro. Por ejemplo, el maíz transgénico que se cultiva en España lleva genes de bacteria que le permiten producir una sustancia insecticida.
La diferencia fundamental con las técnicas tradicionales de mejora genética es que permiten franquear las barreras entre especies para crear seres vivos que no existían en la naturaleza. Se trata de un experimento a gran escala basado en un modelo científico que está en entredicho.
Algunos de los peligros de estos cultivos para el medio ambiente y la agricultura son el incremento del uso de tóxicos en la agricultura, la contaminación genética, la contaminación del suelo, la pérdida de biodiversidad, el desarrollo de resistencias en insectos y "malas hierbas" o los efectos no deseados en otros organismos. Los efectos sobre los ecosistemas son irreversibles e imprevisibles.
Pero como todos hemos de saber, Greenpeace está en contra de los alimentos transgénicos, así que veamos alguna otra fuente que aprueba el uso de alimentos transgénicos:
El principal avance de la Ingeniería Genética consiste en la capacidad para crear especies nuevas a partir de la combinación de genes de varias existentes, combinando también por lo tanto sus características. Cultivos con genes de insectos para que desarrollen toxinas insecticidas o tomates con genes de pez para retrasar la marchitación han dejado hace tiempo de ser ciencia-ficción para constituir una realidad en nuestros días.
Permitir el cultivo de hortalizas en áreas desérticas hasta ahora estériles o aumentar el tamaño de los frutos cultivados son algunos de los adelantos que la utilización de este tipo de técnicas pueden aportar a la Humanidad, con los logros que supone hacia la erradicación del hambre en el Mundo. Lo que no se ha definido todavía es cómo compatibilizar estos objetivos con los intereses económicos de las empresas de biotecnología que los desarrollan. ¿Qué opinas tu?
Referencias:
http://www.greenpeace.org/espana/campaigns/transgenicos
http://www.lector.net/versep98/inge.htm
Wednesday, April 18, 2007
Manuel PeimbertDescubridor de mapas de información sobre la evolución del universo
De mil 400 nebulosas conocidas en nuestra galaxia, 200 han sido descubiertas por astrónomos mexicanos. Parte de esa aportación le pertenece al doctor Peimbert Sierra, quien estudió en la Facultad de Ciencias de la UNAM y después realizó un doctorado en la Universidad de California (Berkeley), Estados Unidos. Su línea de trabajo se centra en el estudio de las condiciones físicas del medio interestelar y de nebulosas planetarias en nuestra galaxia y en otras.
"Me dedico a observar nebulosas gaseosas en el espacio interestelar, y éstas son de varios tipos. Existen los sitios donde se están formando estrellas, llamadas regiones de hidrógeno ionizado. Otras son las nebulosas planetarias, es decir, nubes de gas expulsado por estrellas en su etapa de transición entre gigantes rojas y enanas blancas. He observado también remanentes de supernovas y gas en núcleos de galaxias. Con esas observaciones se pretende determinar la composición química de esos objetos y tratar de probar las teorías que hay sobre la evolución de las estrellas, la evolución de las galaxias y la evolución del universo en su conjunto.
"Al estudiar la composición química se puede saber qué tan contaminada está una galaxia y qué fracción de su masa inicial de gas se ha convertido en estrellas. Ello con el propósito de estudiar teorías de evolución de galaxias. Lo mismo en el caso de las nebulosas planetarias, la composición química muestra el resultado de reacciones nucleares que hubo en el interior de las estrellas."
Sobre nebulosas planetarias, el doctor Peimbert también ha establecido una clasificación ampliamente usada en el ámbito científico basada en su composición química. Asimismo, ha trabajado en el origen e historia de los elementos químicos que se formaron con el universo y los que conocemos actualmente.
Para el investigador, la astronomía es una de las ciencias más bellas desde el punto de vista de sus imágenes y su generalidad. "Estamos preocupados por el universo en su conjunto, por nuestra posición en él y por el presente y futuro de todas las cosas".
Es por ello, subraya, que si se desarrolla la astronomía o cualquier otra ciencia debido a las interacciones que hay entre todas, ello se va a trasladar a un mejor desarrollo general, ya que la ciencia básica es el sustento de la ciencia aplicada, el puente hacia la tecnología y la economía y, por lo tanto, de las cosas que nos afectan todos los días.
"Hay países que generan mucho conocimiento en ciencia y otros no. Los que producen poco dependen de los primeros. El salario en las naciones desarrolladas es 10 veces más alto que en las tercermundistas. Estamos atrasados en investigación y en educación, y en general en todas las áreas de creación.
"En este momento, en México hay un científico por cada 10 mil habitantes, y en los países del Primer Mundo hay 20 por cada 10 mil. A las universidades sólo llega 17 por ciento de los jóvenes en edad de cursar estudios superiores, mientras que en los desarrollados llega 50 por ciento.
"Eso no quiere decir que no haya talento en México, lo que pasa es que tenemos una serie de rezagos por resolver. Aunque a un joven le parezca difícil llegar a ser músico, actor, poeta o astrónomo, sólo necesita dedicarse a cualquiera de esas actividades con constancia y pasión. No se necesita ser genio para ser científico, sólo trabajo para tener éxito."
Tuesday, April 17, 2007
¿Que opina la sociedad con respecto a la Nano?
Las personas que apenas tienen conocimiento de esta nueva tecnología reaccionan al instante de forma emotiva ya que relacionamos la palabra tecnologìa con el avance y progreso, Los investigadores observaron que valores individuales de cada persona determinan su reacción ante la información acerca de esta nueva tecnología, por ejemplo las personas con fuertes valores individualistas, que suelen descartar las ideas de que el comercio y la industria son peligrosos y se deben regular, tienden a centrarse en los beneficios de la nanotecnología cuando reciben información sobre ella, pero las personas con valores comunitarios y de igualdad, que suelen ser más sensibles con los riesgos tecnológicos y medioambientales, se centran en los riesgos.
A estas actitudes en la gente son a lo que los psicólogos sociales llaman efecto de polarización. El equipo del Cultural Cognition Project planea encontrar nuevas formas de comunicar información sobre la nanotecnología que no polaricen a la gente.
Esta encuesta también muestra los resultados que ponen de manifiesto que los estadounidenses increiblemente desconocen en gran medida este campo, a pesar de la enorme inversión que tanto su gobierno como la industria están realizando en él y de los muchos productos que se encuentran saliendo al mercado.
El estudio ha sido financiado por la National Science Foundation (NSF), el Fondo Oscar M. Ruebhausen de la Facultad de Derecho de Yale y el Project on Emerging Nanotechnologies.
fuente: http://www.euroresidentes.com/Blogs/noticias/nanotecnologia.htm
Friday, April 13, 2007
Nitruros...
Como ejemplos tenemos a los siguientes compuestos:
· K3N Nitruro de potasio
· Mg3N2 Nitruro de magnesio
· Cu3N2 Nitruro de cobre
· BN Nitruro de boro
· SbN Nitruro de antimonio
· BiN Nitruro de bismuto
· CeN Nitruro de cerio
· Ti3N Nitruro de talio
· N3S2O6K Nitruro polisulfato de potasio
Reacciones típicas
K3N + 3 H2O --> 3 KOH + NH3
CeN + 2H2O --> CeO2 + NH3 + 1/2 H2
Singularidades
· El Nitruro de cerio se pone incandescente con la adición de gotas de agua o agua pulverizada.
· Varios nitruros han sido encontrados en la combustión inicial de ciertos metales como el Magnesio, Litio, Titanio, que son capaces de arder en atmósfera de Nitrógeno, según la reacción siguiente: Mg3N2 + 6 H2O --> 3Mg(OH)2 + 2 NH3
Los nitruros metálicos de transición (NMT), se han caracterizado por incrementar la resistencia al desgaste y a la corrosión en los aceros. También son materiales de gran importancia tecnológica con muchas y muy variadas aplicaciones como la fabricación de electrodos, materiales magnéticos, conductores, superconductores y revestimientos cerámicos, incluso como catalizadores.
El proceso industrial de como se desarrollan o mejoran superficies metalicas se decribe a continuación:
El objetivo principal de la nitruración iónica es mejorar las propiedades superficiales de piezas para maquinaria, herramientas y matrices, obteniendo una mayor dureza superficial, resistencia al
desgaste, fatiga y corrosión.
Dicho proceso es aplicable con total eficiencia en aceros, fundiciones, materiales sinterizados y
aceros inoxidables.
El tratamiento se realiza en vacío y bajo el efecto de un campo eléctrico, las moléculas de nitrógeno se disocian. A causa de una diferencia de potencial (300-1000 V), los iones positivos son
lanzados sobre el cátodo constituido por las piezas a tratar, sobre las que se provoca un calentamiento por transformación de energía cinética de los iones, defectos en la red, pulverización
de átomos en la superficie y una limpieza superficial lo que favorece la reactividad fisicoquímica necesaria para la formación de nitruros metálicos en la capa superficial. En las piezas
nitruradas aparecen dos zonas: capa blanca y zona de difusión. La capa blanca está constituída esencialmente por nitruros Fe2-3N y Fe4N; dependiendo de los parámetros de tratamiento la capa
puede estar ausente, presentar una mezcla de ambos nitruros o solo alguno de ellos.
En la zona de difusión ocurren diversas reacciones debido a la difusión de nitrógeno, éstas son precipitación de nitruros, saturación de la red de Fe, tensiones residuales, redistribución de
carbono. Si el acero tiene elementos tales como Cr, Al que tienen gran afinidad por el N, se facilita la formación de nitruros de CrN u AlN.
Muchas ventajas son obtenidas con la utilización de este proceso en comparación con los tratamientos convencionales, bajas temperaturas de tratamiento, aplicable a aceros inoxidables sin disminuir su resistencia a la corrosión. El preciso control de las variables de proceso posibilita obtener capas de compuestos y zona de difusión adecuadas, sin producir efluentes contaminantes
El procesamiento de superficies por plasma ha tenido un gran desarrollo industrial en las últimas décadas, en especial la nitruración iónica...
Pueden encontrar mas infromación sobre este proceso en el sigueinte link:
http://www-biblio.inti.gov.ar/textos/304495.pdf
Algo sobre polioxometalatos...
Se conocen dos tipos de polioxoaniones según la clase de elemento constituyente:
1. los representados por los silicatos y oxoaniones de elementos (semimetálicos o no metálicos) vecinos (B, P, S, Ge, As, Se, Sb, Te y I)
2. los formados por metales de transición de los grupos 5 y 6, (V, Nb, Ta, Cr, Mo, W).
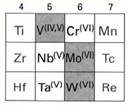
Elementos d que forman polioxometalatos. Los elementos sombreados forman una variedad mayor de polioxometalatos
Con frecuencia, es conveniente representar las estructuras de los polioxometalatos mediante poliedros, debiéndose entender que el átomo central está ubicado en el centro y los átomos O en los vértices. La compartición de los átomos O de los vértices en el ion dicromato se puede representar de la forma tradicional o mediante poliedros (13).


Generalmente los polioxometalatos son octaedros, tetraedros o pirámides de base cuadrada.

Estructuras de polioxoaniones. En el centro de cada octaedro hay un ion
W(VI), y en el centro del tetraedro hay un ion P(V). Los vértices de los poliedros
son aniones oxo. Anión de Keggin XW12O40 (centro) y esquema de la eliminación de una triada de octaedros, dando lugar al ligando hexacoordiante (izquierda) y al heptacoordinante (derecha)
Los aniones polioxometalato suelen prepararse mediante cuidadoso ajuste del pH y de la concentración. Los polioxomolibdatos y polioxowolframatos se froman por acidificación de las disoluciones de los molibdatos y wolframatos simples. El (W12O40(OH)2)10- es otro ejemplo de polioxometalato(14).

Además de los numerosos polioxomolibdatos y polioxowolframatos existe una amplia familia de heteropolimolibdatos y wolframatos en los que hay incorporados fósforo, arsénico y otros heteroátomos. Por ejemplo, (PMo12040)3- al cual se le pueden agregar diversos heteroátomos a su estructura, resultando la fórmula general (X(n+)Mo12O40)(8-n)-, donde (n+) representa el estado de oxidación del heteroátomo, que puede ser As(V), Si(IV), Ge(IV) o Ti(IV). Con el heteropolianión análogo de wolframio se observa un intervalo todavía más amplio de heteroátomos. Los heteropolimolibdatos y wolframatos pueden sufrir reducciones de un solo electrón sin modificar la estructura, pero con formación de un color azul intenso. El color parece que se debe a la transición del electrón añadido desde una posición de Mo(V) o W(V) a una posición adyacente de Mo(VI) o W(V).
Algunas aplicaciones de los polioxometalatos
Los polioxometalatos tienen muchas aplicaciones interesantes:
- como catalizadores (homogéneos y heterogéneos), se utilizan ampliamente, tanto en reacciones redox, por su flexibilidad y capacidad para aceptar y devolver electrones, como en catálisis ácido-base, por su carácter de ácido fuerte,
- en biomedicina, por su gran tamaño y carga, su capacidad redox y su estabilidad a pH fisiológico, donde han mostrado actividad en la inhibición enzimática, para el tratamiento de tumores y contra virus y retrovirus,
- como agentes precipitadores de proteínas, por ejemplo en la detección del colesterol de alta densidad en humanos o en aplicaciones alimentarias o de la industria del tabaco,
en algunos procedimientos de química analítica, al ofrecer la posibilidad de formar compuestos con una gran variedad de elementos, y posteriormente utilizar la solubilidad o las propiedades espectroscópicas de estos heteropolioxometalatos para determinaciones cuantitativas o cualitativas, - en membranas y sensores, aprovechando la alta conductividad iónica de los polioxometalatos, su capacidad para formar sales con diversos cationes y su capacidad para sufrir procesos redox (afectados por los cationes que los acompañan) bajo diversas condiciones,
- en el diseño de nuevos materiales, ya que los avances recientes sobre procesos de transferencia electrónica e interacciones de canje magnético en polioxometalatos de nuclearidad y complejidad topológica crecientes, capaces de combinar diferentes iones metálicos y/o partes orgánicas en el mismo sistema, han abierto la posibilidad del diseño de nanomateriales compuestos con POMs y,
- en el diseño y estudio de clusters magnéticos, la síntesis y estudio de híbridos orgánico-inorgánicos formados por una matriz polimérica conductora y un anión polioxometálico (molibdeno y wolframio) con actividad fotoquímica y electroquímica es uno de los temas de investigación más relevantes. Además de su uso como cátados en baterías recargables, el anclaje de los aniones fotoactivos en el sólido permite su aplicación como electrocatalizadores fijados en un soporte conductor.
Bibliografía
Atkins, P.W. Química Inorgánica. Volumen 1. Editorial Reverté. 2da reimpresión. Octubre 2001. Barcelona, España.
Gómez, Romero Pedro. Temas de investigación: polioxometalatos. (En línea) Consultado el 17 de marzo del 2007:
http://www.cienciateca.com/pgrid.html
Gaita, Ariño Alejandro. Canje magnético y transferencia electrónica en polioxometalatos: Estudios mediante dispersión inelástica de neutrones, hamiltonianos modelo y cálculos ab initio. (En línea) Consultado el 17 de marzo del 2007:
http://www.uv.es/~gaita/tesis.pdf
Oxocomplejos

Oxocomplejos
Ø Metales en altos estados de oxidación, particularmente en el alto pH, tienden a formar los complejos oxo o hidroxo más que las especies aquo - MnO4 -, CrO 42-, WO42- ,VOL42+
Ø El ligando Oxo tiene un enlace doble al metal. Hay considerable interacción π entre el metal y el ligando
Ø Es absolutamente común encontrar en posición trans un ligando oxo a ser vacante u ocupado por un ligando enlazante débil debido a la interacción π
Oxocomplejos del Ru
Ø El diagrama de Pourbaix muestra:
- el alto pH favorece la conversión del ligando del aquo a un ligando del hidrozoo y conversión del hydroxo a oxo.
- Incrementando el estado de la oxidación se favorece a la conversión de un ligando aquo a un ligando hydroxo y conversión de hydroxo y oxo

Ejemplos y explicaciones de algunos oxocompuestos y complejos
Como ocurre en el Mo y W, los oxocompuestos son importantes, en especial en los estados de oxidación V y VII.
Las sales del ion perrenato, ReO4‑, tienen solubilidades similares a los percloratos, pero las del TCO4‑ son las más solubles. El ión tetrafenilarsonio, Ph4 As+, forma un perrenato insoluble apropiado para análisis gravimétrico.
Los iones son estables en el agua y son oxidantes débiles. En solución de HCI, el ReO4‑ se reduce parcialmente por el hipofosfito al clorocomplejo ReI IV Cl6 2‑ que forma sales estables como el K2ReCI6, y al ion Re2 Cl8 2‑, que es isoelectrónico con el Mo2 Cl8 4‑ y contiene un enlace cuádruple entre los átomos metálicos.
Oxocomplejos. Como en el caso del Mo, existen numerosos oxocomplejos. El Re2Cl10 se disuelve en una solución acuosa de HCl concentrado formando el ion [ ReOCI5 ]2‑. Las oxoespecies pueden contener grupos Re = O, Re‑O‑Re y traes O = Re = O (el MoVI tiene grupos dioxo cis) y grupos lineales O = Re‑O‑Re = O.
Existe una amplia química de los compuestos de oxorenio(V) con ligandos fosfina. Los complejos ReOCl3 (PR3 )2 se obtienen por interacción de ReO4‑ con PR3 en etanol que contiene HCI. El ion haluro (u otro ligando) opuesto al enlace Re = O es lábil; en etanol, por ejemplo, se sustituye rápidamente formándose ReOCl2 (OEt)(PR3 )2.
Oxocompuestos de rutenio y osmio
Uno de los hechos más característicos de la química del Ru y Os es la oxidación por agentes oxidantes en solución acuosa formándose los tetraóxidos volátiles.
El RuO4 amarillo anaranjado (pf 25°C) se forma cuando las soluciones ácidas que contienen Ru se oxidan por MnO4‑, Cl2 o HClO4 caliente. Puede destilarse desde las soluciones o arrastrarse en corriente gaseosa.
El OSO4 incoloro (pf 40°C) se obtiene con mayor facilidad y como oxidante fuerte basta el HNO3. Las destilaciones, en primer lugar del OSO4, y a continuación del RuO4, se usan para separarlos de los metales del platino restantes. El RuO4 se recoge en soluciones concentradas del HCl en las que se reduce a una mezcla de clorocomplejos de RuIII y RuIV . El producto evaporado se vende como "RuCl3 · 3H2 O", que es el material de partida más común para la síntesis de compuestos de Ru.
Los tetraóxidos constan de moléculas tetraédricas. Se extraen desde las soluciones acuosas mediante CCl4. Los dos compuestos son agentes oxidantes poderosos. El OSO4 se emplea en química orgánica para la oxidación de olefinas a cis‑dioles. También se utiliza como tintura biológica, ya que la materia orgánica lo reduce. Es especialmente peligroso para los ojos, por lo que debe manejarse cuidadosamente. El RuO4 es mucho más reactivo y puede reaccionar vigorosamente con la materia orgánica; es muy tóxico.
Por disolución de OSO4 en medio básico se obtiene un oxoanión incoloro
OsO4 + 20H‑ = [OsO4(OH)2]2-
que puede reducirse a [OSO2 (OH)4 ]2‑.
El oxorutenato RuO4 2‑ naranja mucho menos estable se obtiene por fusión de los compuestos de Ru con Na2O2 y posterior disolución del fundido en agua. La diferencia en la estequiometría puede deberse a la capacidad mayor del anión 5d para aumentar su esfera de coordinación.
La reducción del RuO4 por el HCl en presencia de KCl produce cristales rojos de K4 [ Ru2 OCl10]. Esta oxoespecie de RuIV (d4 ) es diamagnética ya que los electrones se aparean en un orbital molecular que se extiende sobre el grupo puente lineal Ru‑O‑Ru
la caida de la muralla del oxígeno
For the first time ever, Emory University researchers have broken through the so-called "oxo-wall" to create stable multiple chemical bonds between oxygen and platinum – once thought impossible because oxygen is extremely unstable when combined with certain metals. The breakthrough holds the potential for numerous applications in fuel cells, catalytic converters and emerging 'green' chemistry.
Chemical bonds between metals and oxygen are known as metal-oxo species, and are found in a multitude of molecules and materials. They are dominant in the chemistry, geology and biology of many metal elements, especially during oxidation – one of the most basic and fundamental of chemical reactions. However, metal-oxo species become increasingly less stable as one moves from left to right on the periodic table. Until this work, attempts to create metal-oxo species with elements such as gold, platinum, silver, iridium and rhodium have been unsuccessful.
"The existence of such metal-oxo complexes has been presented and debated in many public forums but never realized until this research. Since this metal-oxo is a unique compound, both its physical properties and its chemical reactivities should provide new insights and break new ground," says principal investigator Craig Hill, Goodrich C. White Professor of Chemistry at Emory.
The paper will appear in the Nov. 25 edition of Science Express, an online publication of selected research papers that have recently been accepted for publication in the journal Science.
"Oxygen is usually very unreactive in its molecular state as O2, or, when you do break the bond, it reacts uncontrollably. In nature, iron is one of the most versatile elements in its ability to control oxygen, and can pluck a single oxygen atom and transfer it where it wants to go. We wanted to take what nature knows how to do with iron, and do it ourselves with other metals," says Travis Anderson, lead post-doctoral researcher for the project. He says the next step will be to create metal-oxo bonds with platinum's neighbors on the periodic table.
"Out of the 12 metals that have been behind this 'oxo-wall' in columns 9-12 of the periodic table it is very exciting that we were able to create metal-oxo compound with platinum since it is an excellent catalyst for environmentally friendly processes," Anderson says.
Stable compounds of platinum and oxygen could be centrally important to the operation of automobile catalytic converters. Catalytic converters use a platinum catalyst to interact with oxygen in the air to form highly reactive platinum-oxygen intermediates and other species that fully combust the partially burned fossil fuels emanating from the internal combustion engine. The platinum-oxo compound is expected to be a model for these highly elusive platinum-oxygen intermediates and, as such, could provide key insights into improving existing technology.
One important and growing technology where the platinum-oxo unit may also be key is fuel cells. The electrodes in these cells are frequently based on platinum, and in some instances the reaction of platinum with oxygen is central to their operation.
In addition, metallic platinum has long been known to be an excellent catalyst for oxidations of organic compounds. Today, oxidations by O2 (including air) are of considerable and growing interest in part because they are quite green. In other words, such organic oxidations, which are important in several industries, can, in principle, generate fewer inorganic by-products, work under more benign conditions, permit products to be separated more easily and generate less waste. Platinum-oxo species could well be the critical intermediates in these diverse O2-based oxidations.
The Science paper was authored by Hill; Anderson; chemistry professor Keiji Morokuma; Jamal Musaev, manager of Emory's Cherry L. Emerson Center for Computational Chemistry; Emory graduate students Wade Neiwert and Rui Cao; and collaborators at Argonne National Lab and the University of New
Mexico. http://www.eurekalert.org/pub_releases/2004-11/euhs-ecc112204.php
Lección maxistral 'La química supramolecular: la química LEGO'
José Vázquez Tato
Excmo. y Magfco. Sr. Rector, Excmos. e Ilmos. Sres, Sras. y Sres., amigos todos:La tradición arraigada de este Acto Académico, conmemorativo de la celebración de nuestro patrón Santo Tomás de Aquino, exige el desarrollo de una lección que el protocolo califica de Magistral. En el presente caso, este es un calificativo otorgado con excesiva generosidad por cuanto, no siendo más que un aprendiz de los verdaderos maestros de la disciplina, a los cuales simplemente me atrevo a comprender y a seguir en la investigación a considerable distancia, dificilmente puedo pretender sentirme maestro y mucho menos impartir lecciones magistrales. Si me he atrevido a aceptar el ofrecimiento del Excmo. y Magfco Sr. Rector para impartirla es únicamente porque al final de la misma no se hacen preguntas que evidencien mis múltiples carencias en el tema. Espero que al menos no se aburran y para ello recurriré a recordarles otros tiempos.
¿Quién no ha crecido, o al menos no ha jugado con su descendencia, con los ladrillos de la firma danesa LEGO, los cuales, con imaginación, paciencia y esfuerzo permiten construir torres, castillos o trenes? En la actualidad, la afición no queda limitada a los menores por cuanto que está ampliamente arraigada y difundida entre los adultos, como veremos inmediatamente.
Quizá pueda parecer publicidad gratuita o falto de rigurosidad suficiente el que en una conferencia de la categoría que se le debe suponer a ésta, aparezca en su título el nombre de una marca comercial. Pero en este caso, la denominación LEGO ha trascendido más allá de la marca acabando por definir un tipo de producto o juego. Otro ejemplo bien conocido es el Rimel para las pestañas ya que actualmente existen muchas marcas de "rimel".
En cualquier caso, vaya en mi descargo, que mi atrevimiento es ínfimo comparado con el de Brendan Powell quien ha recreado la Biblia. Ejemplo de su esfuerzo es La Ultima Cena, que, sin intención de ofender sensibilidades, permítaseme que la compare con otras ilustres "Ultimas Cenas" y aunque aquí sólo ilustro la comparación con las de Ghirlandaio, Bassano, Dalí y Florea, también podría compararse con las de Leonardo da Vinci, El Greco, Tiziano, Murillo, Sassu o Warhol.
Aunque apenas lleve un par de minutos de conferencia, a estas alturas no debe ya soprender la afirmación de que con estos ladrillos se hayan construido los objetos más diversos. Entre ellos me gustaría resaltar algunos objetos matemáticos como la banda de Moebius, el punto de silla (muy útil para explicar el estado de transición de una reacción química), Bart Simpson, El Pensador de Rodin, una mesa de despacho y otras que veremos más adelante, de las que son autores Andrew Lipson y Eric Harshbarger.
En la actualidad LEGO vende en torno a 200 millones de juegos al año en más de cien países y tiene más de 8.000 empleados. Fue fundada en 1932 por Ole Kirk Christiansen, en Billund (Dinamarca), aunque tal nombre fue adoptado en 1934. El mismo prodede de las palabras danesas "LEg GOdt" que significan "jugar bien". Lo curioso del caso es que en latín lego significa "leer" y "reunir." Por la denominación utilizada y para los propósitos de esta conferencia, es interesante resaltar que el predecesor del actual y familiar ladrillo fue creado bajo el nombre de Ladrillos Enlazantes Automáticos y destaco la palabra enlazante por sus evidentes connotaciones químicas.
El LEGO revolucionó el mundo del juguete ya que el jugador podía crear y crecer sin necesidad de seguir unas líneas marcadas de antemano. También deseo remarcar las palabras crear y crecer por cuanto han de ser las guías de toda actividad humana: musical, artística, artesanal,... y ¿cómo no? de la ciencia y la investigación. Desafortunadamente no siempre es así, por cuanto, no sólo es difícil ser creativo, sino que también lo es analizar el valor final al que puede dar origen la creatividad. Permítanme que les manifieste que tengo la sensación personal de que muchas de las ideas que han dado origen a realidades cotidianas actuales, que en su momento representaron novedades insospechadas, posiblemente no fuesen financiadas en estas latitudes. Sin ánimo de extenderme en este punto, me atrevo a afirmar que parte de la razón estriba en la forma con la que se escriben y analizan los proyectos de investigación. Se escriben con la rigidez clásica del soneto: 14 versos endecasílabos o alejandrinos, con rima consonante repartida en dos cuartetos y dos tercetos. El famoso "Érase un hombre a una nariz pegado..." de Francisco de Quevedo es quizá el ejemplo más difundido. Se analizan con parámetros históricos como experiencia previa o publicaciones en el tema objeto del proyecto, del que, como es obvio, si es novedoso, dificilmente alguien tendrá mucha experiencia o publicaciones previas. De no cumplir estas premisas, las posibilidades de recibir financiación son nulas.
La propia ejecución de un proyecto ya financiado sigue siendo muy rigida porque la misma ha de, necesariamente, someterse a la consecución de los objetivos enumerados en el proyecto. Con esta metodología el investigador se va autoencorsetando, autorrestringiendo su creatividad y ejecutando la ciencia más estándar posible que, sin duda, si se analiza desde la visión del egoismo personal, es la más rentable. Desde aquí propongo que debemos dejar volar la imaginación y dedicar un porcentaje (cualquiera que sea su valor numérico) a proyectos imaginativos que pretendan dar saltos cuantitativos en el mundo de la ciencia. Estoy totalmente convencido de que sus diseñadores/ejecutores alcanzarán siempre resultados magníficos aunque no correspondan en absoluto a su idea original.
Ahora bien, la sociedad tiene que estar dispuesta a financiar la creatividad, la imaginación. Confieso que, salvo momentos esporádicos, mi vida universitaria ha estado siempre más pendiente de decidir si puedo o no comprar una bombona de argón que de analizar el que dos moléculas se ensamblen. Es urgente que España duplique, al menos, sus gastos de investigación, atendiendo a las infraestructuras y al gasto ordinario, pero sobre todo al personal investigador, que es quien, en definitiva, puede poner la imaginación. De no hacerlo así se verificarán las palabras de Salvador Moncada (el segundo científico más citado de los últimos veinte años) cuando afirma: "Si no financiamos la investigación, nuestros mejores cerebros se dedicarán a jugar en bolsa".
Aparcaré la reflexión anterior y volveré a mi juguete. Para mis propósitos analizaré en primer lugar cómo es el sistema de ensamblaje de las piezas del LEGO. En pocas palabras podemos decir que se basa en el viejo sistema de machihembrado tan común en carpintería y ebanistería (no sin razón, Ole Kirk Christiansen era maestro carpintero) y en el simple hecho de que cada pieza posee simultáneamente la dualidad macho-hembra. En Química Supramolecular, al macho suele denominársele huésped o donante y a la hembra hospedador o aceptor. Tal dualidad en la misma pieza permite que, después de un ensamblaje, la pieza resultante mantenga la característica dual macho-hembra tal y como muestra la figura. La figura muestra también el sistema de engarce mecánico entre las piezas, el cual permite que se mantengan unidas y estables en su posición, ilustrando cómo encajan macho y hembra tras su unión.
El catálogo de piezas del sistema LEGO es muy amplio, manteniendo todas ellas el mencionado sistema de ensamblaje. Las piezas, si se descartan las especiales para acabados, de carácter técnico (como ruedas), accesorios temáticos, puertas, ventanas, tejados, etc., pueden clasificarse como piezas de la forma m´n donde m varía entre 1 y 2, y n entre 1 y 8.
Me detendré por un momento en la pieza 1´1. Es obvio que sólo permite construir columnas monodimensionales. Si cada pieza 1´1 recibe el nombre de monómero, la columna resultante es un polímero. La diferencia entre un polímero químico convencional y la columna del LEGO es que, en el polímero, el monómero ha perdido su verdadera identidad. Por ejemplo, el monómero estireno origina por polimerización radicalaria el poliestireno (altamente utilizado como aislante térmico o para las conocidas bandejas blancas para la fruta y la carne de cualquier tienda o supermercado). La diferencia no sólo radica en la nomenclatura, sino también en su estructura química y en sus propiedades físicas, químicas y biológicas. Así, el estireno (monómero) es cancerígeno, mientras que el poliestireno no lo es. Precisamente uno de los retos que han de afrontar los fabricantes de poliestireno expandido es la de garantizar que no permanezcan residuos de monómero en el producto final.
Las proteínas son un excelente ejemplo de polímero macho-hembra. En ellas los distintos aminoácidos se unen entre sí mediante enlaces amida resultado de la unión del grupo ácido de un residuo con el grupo amino del residuo adyacente. Esta secuencia de aminoácidos constituye la estructura primaria de la proteína. Por lo tanto, las piezas LEGO 1´1, en las que cada color podría representar un aminoácido diferente, sólo permiten dar cuenta de la estructura primaria de la proteína. Ello es debido a la rigidez de los ensamblajes en el LEGO, rigidez parcialmente ausente en una proteína como consecuencia del giro, relativamente libre, alrededor de los enlaces. Las interacciones internas permiten comprender las estructuras secundaria y terciaria de las proteínas.
Decía que en un polímero químico convencional el monómero ha perdido su verdadera identidad. Esto no es así en un polímero supramolecular. Un ejemplo lo clarificará mejor. La molécula que muestro a continuación está formada por dos residuos, macho y hembra, esto es, huésped y hospedador. En este caso, el hospedador es la b-ciclodextrina y el huésped el grupo adamantilo. En la figura de la derecha muestro una representación esquemática del derivado. Si el mecanismo de machiembrado comentado para el LEGO funciona con el ladrillo químico, la columna resultante sería la que recojo esquemáticamente en la figura y que también puede modelarse con las manos. Debo remarcar que, como en el caso del LEGO, la columna resultante mantiene la característica dual macho-hembra, huésped-hospedador.
Ahora bien, el engarce en el LEGO es de carácter mecánico pero ¿cuál es el engarce en el LEGO químico? Obviamente son las fuerzas intermoleculares de las que la más importante es el enlace de hidrógeno al que dedicaré una atención especial un poco más tarde. Para comprender mejor el proceso de machiembrado químico dedicaré unos momentos a analizar la estructura, propiedades y aplicaciones de las ciclodextrinas.
Las ciclodextrinas son un grupo de moléculas naturales cíclicas constituidas por unidades de glucopiranosa unidas por enlaces a(1,4). Las denominadas naturales tienen 6, 7 u 8 unidades denominándose, respectivamente, a-, b- y g-ciclodextrina.? La figura muestra la estructura troncocónica hueca del derivado b- y el valor aceptado para el diámetro de su cavidad, aproximadamente 6,3 Å. Esta cavidad tiene un fuerte carácter hidrófobo.
Debido a su estructura cíclica hueca, las ciclodextrinas pueden hospedar distintos compuestos formando complejos de inclusión cuya estequiometría más usual es 1:1. Esta peculiar característica de formar complejos de inclusión estables, permite que las ciclodextrinas tengan multitud de aplicaciones en farmacología, biotecnología, tecnología de alimentos, cosmética, química analítica, etc.,
Las fuerzas intermoleculares que hacen posible que se forme el complejo son fuerzas de Coulomb, dipolo-dipolo, van der Waals, enlaces de hidrógeno, etc. que impiden la separación de los componentes. Además la formación de un complejo de inclusión requiere de una compatibilidad geométrica, esto es, las ciclodextrinas son capaces de formar complejos de inclusión con componentes que tienen un tamaño comparable a las dimensiones de su cavidad. En términos ebanísticos, la caja no puede tener un diámetro menor que la espiga. Al tener distinto diámetro interno, la a- b- y g -ciclodextrina son capaces de acomodar moléculas de distinto tamaño.
Es hora de que vuelva a la columna química LEGO. En primer lugar se disolvió el producto en la mínima cantidad posible de dimetilformamida y a continuación se recristalizó en agua. La resolución del cristal ha permitido poner de manifiesto la obtención de un polímero supramolecular en forma de columna como consecuencia del autoensamblaje del ladrillo básico, en el que el grupo adamantilo (macho) se inserta en la cavidad de la ciclodextrina (hembra) de una molécula adyacente, entrando por el lado más amplio de la ciclodextrina. En definitiva el sistema LEGO también funciona en química.
En el catálogo LEGO no se ofertan piezas macho-macho ni hembra-hembra, a pesar de que con ellas se podrían obtener los mismos ensamblajes y por lo tanto las mismas estructuras finales. La razón parece obvia por cuanto que ello obligaría a LEGO a disponer de dos tipos de piezas que, en realidad, al ensamblarse se transforman en un montaje con terminales macho-hembra. Así que no merece la pena multiplicar el número de piezas básicas de un modo innecesario.
Pero en Química las piezas duales huésped-huésped y hembra-hembra pueden ofrecer ventajas. En primer lugar, en este tipo de piezas, al ser idénticas las dos posiciones de ensamblaje, los acoplamientos por uno u otro lado son indistinguibles. La consecuencia es una simplificación elevada de las ecuaciones definitorias de los equilibrios químicos implicados. En segundo lugar, la síntesis de especies simétricas es mucho más fácil que la de especies asímetricas, entre otra razones, por la ausencia de selectividades específicas. La obtención del polímero molecular nylon-6,6 a partir de la hexametilendiamina y el ácido adípico es un ejemplo de este tipo de situaciones ya que el polímero se obtiene por reacción de dos especies homoduales macho-macho y hembra-hembra. Merece la pena que destaque que, como en el caso del LEGO, después de una monoadición, el oligómero se convierte en un aminoácido o especie heterodual (macho-hembra). En cualquier caso, también pueden aparecer problemas. Así, si la relación estequiométrica entre ambos tipos de monómeros no es perfecta, el tamaño o peso molecular del polímero resultante baja drásticamente.
En la siguiente figura muestro la obtención de un polímero supramolecular lineal a partir de dos monómeros homoduales con funciones complementarias. El grupo de investigación que tengo el honor de dirigir tiene amplia experiencia en la síntesis de diversos monómeros homoduales que posteriormente son complejados con dímeros de ciclodextrina. Aquí, y por semejanza con la molécula macho-hembra ya estudiada me limitaré a reflejar un dímero de adamantano soluble en agua. Su imaginación puede hacer el resto. Sin embargo, para ayudarla les mostraré algunos de los polímeros lineales ya publicados con una especie natural, no sintética pero dual (o ditópica) como el desoxicolato sódico. Es una especie dual porque forma con monómeros de b-ciclodextrina complejos de estequiometría 1:2. Ya no les sorprenderá el hecho de que con dímeros de ciclodextrina forme polímeros supramoleculares lineales.
Decía que con las unidades 1´1 de LEGO sólo se pueden construir columnas monodimensionales, o lo que es lo mismo, para ejecutar diseños bi- y tri-dimensionales necesitamos recurrir a piezas m´n con m o n mayores que 1. Algún fan del LEGO afirma que la mejor pieza es la 1´3. En Química Supramolecular, para obtener estructuras no lineales, es necesario disponer de oligómeros de orden superior al dímero. Un trímero es más que suficiente. Un simple análisis predictivo de la estructura originable por un trímero homohembra con un dímero dual macho sugiere la formación de "árboles de Cayley". Así que, en el seno del grupo se sintetizó un trímero de ciclodextrina y como huésped ditópico se consideró que el propio desoxicolato sódico, que tan buenos resultados había proporcionado anteriormente, sería una elección suficiente. El resultado obtenido fueron las estructuras fractales que se muestran en la fotografía de la figura que sugieren la obtención del árbol de Cayley.
La característica esencial del LEGO, que lo distingue de otros juegos, es el hecho de que sus piezas, excluídas las específicas, tienen validez universal, esto es, pueden ser utilizadas en la construcción de cualquier objeto, independientemente de su forma y estructura final. ¿Existe esta característica en la Química Supramolecular? Adelanto el sí como respuesta, pero antes de comentar algún ejemplo es necesario que diga algunas palabras sobre el enlace de hidrógeno.
El enlace de hidrógeno es posiblemente la fuerza intermolecular de mayor trascendencia. Puede ser considerado como un caso especial de interacción dipolo-dipolo que aparece entre grupos funcionales D-H y A cuando D y A son átomos muy electronegativos. Al átomo o grupo D, al cual está unido covalentemente el átomo de hidrógeno, se le denomina donante mientras que al A se le conoce como aceptor. La distancia típica entre donante y aceptor está comprendida entre 2,8 y 3,1 Å y su energía de enlace es aproximadamente 20 kJ/mol, es decir, del orden de la vigésima parte de la energía del enlace covalente oxígeno-hidrógeno. Es el responsable fundamental de la estructura secundaria (a-hélice o b-laminar) de las proteínas. El carácter direccional del enlace de hidrógeno es su muy útil para el diseño de arquitecturas supramoleculares.
Para ilustrar la intercambiabilidad de las piezas y, al mismo tiempo, destacar el papel del enlace de hidrógeno, debo comentar los trabajos de diversos autores en los que se forman algunos hexámeros cíclicos. La figura adjunta muestra un ejemplo en el que se incorpora la secuencia aceptor-aceptor-donante de la citosina y la secuencia complementaria donante-donante-aceptor de la guanina, orientadas mutuamente a 120º. Debo hacer notar que ninguna de las secuencias es 100% donante ni 100% aceptora lo que permite un recocimiento entre las moléculas más seguro. La estructura resultante de la autoasociación fue resuelta mediante espectroscopia de rayos X y se mantiene unida gracias a los 18 enlaces de hidrógeno formados.
Con variantes mínimas, la misma unidad básica ensamblante ha sido utilizada para la formación de nanotubos. En la figura observamos, de nuevo, la formación de un rosetón de seis unidades con 18 enlaces de hidrógeno. Los rosetones se apilan formando un nanotubo con doce canales periféricos (formados por los éteres corona, sobre los que volveré más adelante) que pueden servir como canales de iones. El diámetro interior del rosetón es de 11 Å. La estructura del tubo se mantiene por las interacciones electrostáticas, hidrófobas y de apilamiento.
El tercer ejemplo es, sin duda, el más conocido de todos: hablo del DNA. Como es bien conocido su estructura fue propuesta por Watson y Crick, y permítanme que resalte la contribución, no reconocida en un primer momento, de Rosalind Franklin. Menos conocido es el hecho, según historia apócrifa, de que antes de que propusieran la estructura en doble hélice, Watson y Crick habían visitado las escaleras de Santo Domingo de Bonaval. Algunas de las imágenes aquí presentadas pueden verse en movimiento en la página web que se indica y que recomiendo visitar. En cualquier libro de texto de Bioquímica aparecen indefectiblemente los enlaces de hidrógeno entre la timina y la adenina y entre la citosina y la guanina.
Aquí me limitaré a reseñar los hechos fundamentales de la estructura del DNA que, por otra parte son bien conocidos:1) Las dos cadenas, enrolladas una alrededor de la otra, forman una doble hélice girando en torno a un eje imaginario. Las cadenas se mantienen equidistantes a 11 Å.2) El esqueleto helicoidal está formado por una secuencia alternante de desoxirribosa y fosfato, unidos por enlaces fosfodiéster 5'-3'.3) Las cadenas están unidas entre sí mediante pares de bases que se dirigen desde cada cadena al eje central imaginario. Las bases de cada par están en el mismo plano, el cual es perpendicular al eje de la hélice. La adenina se empareja siempre con la timina mediante dos enlaces de hidrógeno, mientras que la citosina se empareja siempre con la guanina por medio de tres enlaces de hidrógeno. Debido a este reconomiento molecular mutuo, las secuencias de bases de ambas cadenas son complementarias. Estas son básicamente las interacciones o piezas que he mostrado en los dos ejemplos anteriores.4) Los pares de bases presentan una rotación de 36º con respecto al par adyacente, de forma que hay 10 pares de bases por cada vuelta de la hélice, dato particularmente interesante para lo que mostraré a continuación.
He dicho que en el DNA real las dos cadenas están enrolladas en torno a un eje imaginario. En una primera versión del DNA, Harshbarger necesitó un eje físico que sirviese de soporte estructural de la doble hélice. La hélice tiene un diámetro de 64 "LEGO bricks" y 1,20 m de altura. Las cadenas laterales (azules) tienen una altura de tres unidades. Cada base está identificada por un color diferente. Debo hacer notar que hay un fallo de construcción: el sentido de giro de la hélice es inverso al correcto. Sin embargo, Harshbarger, a requerimiento de un editor de una revista de genética que la deseaba para ilustrar una portada, construyó una nueva versión que no necesita la columna vertical para mantenerse erguida. De este modelo merece la pena que destaque que tiene "10,5 pares de bases por una vuelta completa de la hélice". Según el propio autor "¡no lo había planificado!".
Antes de continuar me gustaría comentar aquí que muy recientemente ha sido publicada una doble hélice de DNA con una espiral que es un 20% más ancha que la natural. Ello se consiguió gracias a la adición de un anillo bencénico a la adenina (A) y a la timina (T) resultando bases expandidas xA y xT. Estas bases extendidas se hibridan con las naturales originando el DNA expandido o xDNA. La figura adjunta es autoexplicativa. Las dobles hélices de xDNA son más estables termodinámicamente que el DNA natural lo que ha sido atribuido a las interacciones de apilamiento o interacciones p-p entre los anillos aromáticos, es decir, el mismo tipo de interacciones que aparecen en el grafito y que explican la estructura cristalina en forma de espina de pescado del benceno. Como las nuevas bases son fluorescentes podrán ser utilizadas para marcar y observar el DNA.
La capacidad del DNA para formar estructuras supramoleculares es casi ilimitada. Les mostraré sólo algunos ejemplos debidos a N. C. Seeman de la Universidad de Nueva York, líder indiscutible en esta disciplina. A la hora de hacer nanoconstrucciones, el DNA tiene una serie de ventajas, que no describiré por no ser prolijo, sobre otros sofisticados diseños ensamblables.
Para comprender alguno de estos diseños es necesario conocer en primer lugar la unión Holliday que es posiblemente el intermedio de DNA más importante en la recombinación genética. En la figura recojo un ejemplo de unión Holliday que muestra que los parámetros geométricos de la misma son perfectamente conocidos. Esta unión consiste en cuatro cadenas de DNA emparejadas en cuatro ramales de dobles hélices en torno a un punto de ramificación. Si en el entorno del punto de ramificación las cadenas tienen una secuencia simétrica, entonces puede ocurrir la relocalización del punto o migración ramal. La mayoría de la información acerca de los puntos de unión ramificados procede de estudios con uniones inmovilizadas constituidas por complejos de cuatro cadenas en las que se ha eliminado la secuencia simétrica. La figura muestra en movimiento cómo ocurre esta migración ramal. Es claro que una imagen vale más que mil palabras.
A partir de la unión Holliday se pueden construir redes. Para ello es necesario que las terminales de cada cadena tengan complementariedad entre las bases (indicado mediante la utilización de la misma letra con o sin comilla). El cierre de las uniones se consigue mediante una DNA-ligasa. Como las terminales de las uniones mantienen siempre las valencia abiertas, la estructura se puede extender mono- y bidimensionalmente por adición de más monómeros.
Al utilizar DNA doblemente entrecruzado, conocido simplemente como DX y que corresponde a pares de uniones ramificadas de cuatro brazos que han sido ligadas a dos brazos adyacentes, Seeman ha podido conseguir nuevos diseños. Aunque puede sorprender, existen únicamente cinco isómeros posibles, de los que tres tienen dominios paralelos (y que son relevantes en procesos biológicos) y dos son antiparelos, mucho más estables en sistemas con poca separación entre los entrecruzamientos. En la figura recojo estos cinco dominios. A partir de los mismos se pueden conseguir estructuras más complejas por engarce a través de sus extremos complementarios originando, en disolución, formaciones bidimensionales a través de enlaces de hidrógeno. La separación entre los engarces es aproximadamente 32 nm. Seeman también ha desarrollado ensamblajes con moléculas de DNA triplemente entrecruzadas aunque de las mismas no muestro ningún ejemplo.
Para terminar con el capítulo del DNA mostraré las topologías que Seeman ha conseguido con una única cadena. Pueden ser cuatro: círculo, trébol con nudos negativos, ocho y trébol con nudos positivos.
Existen dos tipos de nudos: positivos y negativos. El DNA natural, denominado B-DNA es una molécula con hélices que giran a derechas (como los tornillos). Los entrecruzamientos de las dos cadenas generan nudos negativos. Existe otra forma de DNA, denominado Z-DNA, cuya hélice gira a izquierdas por lo que sus nudos son positivos. Aunque, desde un punto de vista topológico el B-DNA y el Z-DNA son imágenes especulares, en la realidad tridimensional esto no es así porque este último tiene una estructura en zig-zag. El B-DNA puede sufrir una transformación B®Z y originar Z-DNA. La tendencia de un segmento de DNA a sufrir una transformación B®Z depende de dos variables: secuencia de dinucleótidos y modificación de las bases (por ejemplo introduciendo un grupo metilo en la posición 5 de la citosina). La figura adjunta muestra una molécula con dos pares de dominios, cada uno de elllos conteniendo un giro completo de la doble hélice. Cada uno de estos cuatro dominios (o regiones complementarias) es capaz de sufrir la transición B®Z, aunque uno de ellos la experimenta con mayor facilidad. Así:
1) A baja fuerza iónica: ningundo de los dominios forma dobles hélices resultando topología del círculo.2) A mayor fuerza iónica, ambos dominios forman B-DNA, resultando el trébol con nodos negativos. ¿Cómo no? ¡también tenemos el trébol en LEGO!3) En condiciones medias de promoción Z, el dominio más sensible se convierte en Z-DNA, resultando el ocho.4) Finalmente, en condiciones más vigorosas de promoción Z, el segundo dominio también se convierte en Z-DNA, y origina el trébol con nodos positivos.La interconversión entre las distintas topologías está catalizada por DNA-Topoisomerasas I y III.
En relación con lo que comenté al principio, es interesante lo que Seeman recuerda de los intentos de publicar sus primeros trabajos hace aproximadamente veinte años. Al utilizar el DNA como una herramienta química, los revisores o editores de las revistas indefectiblemente preguntaban ¿dónde está la genética? y no publicaban sus trabajos. ¡Eran demasiado novedosos!Pasaré ahora a otro capítulo.
Para la construcción de objetos temáticos o específicos, LEGO dispone de un catálogo ampliamente surtido comprendiendo piezas técnicas como ruedas, ejes, engranajes, motores, fuentes de energía, neumática, etc. ¿Qué nos ofrece la química supramolecular en este terreno?
Para contestar a esta pregunta tengo que retroceder a los años 60 y observar el trabajo de Pedersen, a quien por cierto, no le gustaba escribir trabajos científicos. En su trascendental trabajo que consta de veinte páginas describe la síntesis, identificación, estructura y propiedades de 33 poliéteres cíclicos a los que denominó éteres corona. Asimismo describe la preparación de complejos estables entre estos éteres y cationes como Li+, Na+ y otros. Por lo tanto, el éter juega el papel de hospedador o hembra y el catión el de huésped o macho. Está universalmente reconocido que el trabajo de Pedersen es uno de los pilares iniciales de la Química Supramolecular. Pedersen compartió el premio Nobel de Química de 1987 con Donald J. Cram y Jean-Marie Lehn. Su descubrimiento fue serendípico, esto es por casualidad. El propio Pedersen lo describe así:
"Mi descubrimiento tuvo mucho de casual. Realizando una reacción, observé la aparición de un subproducto blanco, fibroso y cristalino. Una vez que lo aislé, observé que este material era capaz de combinarse con sales inorgánicas como el NaCl y el KCl, haciendo que fuesen solubles en líquidos orgánicos en una forma que antes no había sido posible. Después fui capaz de obtener el producto intencionadamente y diseñar una síntesis sistemática. Se trataba de un poliéter cíclico que al combinarse con la sal inorgánica formaba un complejo en el que el éter cíclico se coloca alrededor del catión metálico de la sal. ¡Fue claramente un descubrimiento serendípico!"
La denominación "éter corona" de los nuevos compuestos supuso una simplificación enorme en su nomenclatura, no extrañándome que, como Pedersen confesó, tuviese dificultades para recordar los nombres sistemáticos. Así el nombre sistemático del primer éter corona que descubrió, cuya imagen tenemos en la figura, es: ¡2,3,11,12-dibenzo-1,4,7,10,13,16-hexaoxacyclooctadeca-2,11-dieno! Lo que nunca confesó Pedersen ¡es que había estado en Lugo y observado la ciudad rodeada por la Muralla!
En la siguiente figura muestro un primer ejemplo de las aplicaciones derivadas del descubrimiento de Pedersen. Así, el [21]corona-7 L-fenilalanina se incorpora a un péptido a-hélice de 21 aminoácidos y 15 residuos hidrófobos de L-leucina. Los residuos del éter corona están ubicados en la cadena de modo tal que pueden alinearse para formar un canal. El canal fue incorporado a una bicapa lipídica sintética y se demostró que los iones la atravesaban. El éter corona fue elegido de modo tal que no formase complejos fuertes con el K+ (lo que sí ocurriría con el [18]corona-6) y así evitar el bloqueo del canal.
El segundo de los ejemplos se refiere al problema de medir K+ en presencia de grandes cantidades de Na+. El problema puede resolverse gracias al criptando adjunto cuyo grupo cromóforo fluoresce con una intensidad proporcional a la concentración de K+. Además, concentraciones de Na+ hasta 145 mM no afectan el análisis. Una de sus aplicaciones concretas se refiere a la determinación de K+ en sangre para lo cual se fija la molécula a un polímero que permite la construcción de un dispositivo que realiza la determinación de un modo continuo.
En el párrafo anterior he utilizado la palabra criptando. Y es que el descrubrimiento de Pedersen desencadenó la obtención de toda una cascada de nuevos contenedores de iones y complejos, algunos de los cuales tienen denominaciones que servirían como títulos de películas de terror: esferandos, criptandos, sepulcrandos, sarcofaguina, calixarenos, sideróforos, etc. En el diseño de los nuevos compuestos se buscaba, entre otros aspectos, que la constante de equilibrio fuese cada vez mayor, eliminando efectos entrópicos desfavorables mediante una menor reorganización de la estructura del receptor o, recuerdo, hembra. Entre los valores más altos figura la complejación de Ag+ por oxaza-éteres corona ya que en agua el logaritmo decimal de la constante es 7,80. Este elevado valor es consecuencia de que, de acuerdo con el principio HSAB, los heteroátomos donantes más blandos aumentan la afinidad de la corona por los metales de transición.
La complejación de cationes por esferandos permitió aumentar el valor de la constante de equilibrio en varios órdenes de magnitud. Así la constante de equilibrio de formación del complejo de Li+ con el esferando de la figura supera el valor de 1016 moldm-3. Este hecho es consecuencia de que el ligando está preorganizado, es decir, no necesita reordenamiento para alojar el catión. El ligando es además rígido para evitar que autorrellene la cavidad.
Sin embargo, estos valores no son nada al compararlos con algunas constantes de complejación del hierro por sideróforos. El hierro es un elemento esencial para la vida. Sin embargo, para las bacterias y los hongos es muy difícil de obtener debido a que la hidrólisis del hierro(III) limita su concentración a un valor tan bajo como 10-18 moldm-3 a pH 7. Para atraparlo estos microorganismos producen agentes complejantes denominados sideróforos. Así, la enterobactina forma complejos extremadamente estables con el hierro(III) ya que la constante de equilibrio para el complejo que mostramos en la figura alcanza el estimable valor de 1052 moldm-3. Una vez dentro de una bacteria, un enzima rompe el esqueleto del complejo y libera el hierro.
¿Puede conseguirse un valor todavía más alto? Esta pregunta retórica tiene la obvia respuesta afirmativa. Pero antes de mostrarla tengo que volver a hacer un paréntesis y hablar de los metalfulerenos endohédricos.
El buckminsterfulereno (nombre original) o fulereno C60 es una molécula constituida por sesenta átomos de carbono. Es esférica de 7-8 Å de diámetro y está formada por doce pentágonos y veinte hexágonos. Cada átomo de carbono ocupa un vértice y se une a otros tres átomos, lo que origina una molécula con un elevado grado de simetría. Es una tercera forma alotrópica del carbono (las otras son el grafito y el diamante), descubierta en 1985 por los premios Nobel de Química H. W. Kroto, R. F. Curl y R. E. Smalley. Su estrutura recuerda un balón de fútbol, una piedra del neolítico o las obras de marquetería de Giovanni. Su nombre original constituye un homenaje al arquitecto Richard Buckminister Fuller quien desarrolló la estrutura del "Domus geodésico". En la actualidad existen otros fulerenos (C70, C76, C84, etc.) que son menos simétricos que el C60 por lo que sus propiedades físicas son inferiores a las de este último.
¿Con qué se podría rellenar la cavidad vacía de los fulerenos y en particular del C60? Algunos autores han decidido rellenar la cavidad con diferentes elementos o iones de la tabla periódica existiendo ya diversos aproximaciones a su síntesis. De este modo surgen los denominados metalfulerenos endohédricos.Para tomar imágenes mediante la técnica de resonancia magnética de imagen (MRI) es necesario utilizar sustancias químicas que originen imágenes brillantes y contrastadas. El fenómeno físico que las explica es la disminución de la relajación de los protones del agua cercana al agente de contraste. Con este fin se utilizan diversos iones, destacando el gadolinio(III) que se utiliza en forma de quelatos de los que el más difundido comercialmente es, con diferencia, el Magnevist. Pues bien, ya se ha conseguido introducir el Gd(III) en el interior del C60 siendo las características fundamentales del complejo las siguientes:
1) La capacidad de relajación del complejo es cinco veces mayor que la del Magnevist debido a que el complejo relaja los protones de las moléculas de agua con enlaces de hidrógeno sobre la enorme superficie del fulereno (>200 Å2).2) Una vez encapsulado el ion, este no puede salir, es decir, su constante de disociación es cero o, equivalentemente, su constante de formación es infinita. Se ha superado a los sideróforos y con el secuestro se impide la toxicidad del ion.3) La carga del complejo es cero.
De todas formas la mínima cantidad sintetizada de estos productos hace que tenga un precio estimado en torno al ¡millón de dólares por gramo! Algún día otros países incluyendo el nuestro pagarán esta investigación.
La segunda forma de llenar la cavidad es con un gas y parece lógico empezar por el hidrógeno. Así se ha sintetizado un fulereno abierto, cuya boca es lo suficientemente grande como para permitir la entrada de una molécula de hidrógeno. La cavidad del fulereno se llena por exposición al gas a 800 atm y 200 ºC durante 8 horas, siendo el rendimiento de la encapsulación del 100%. A temperatura ambiente no existe pérdida del hidrógeno, pero al elevar la temperatura hasta 160 ºC se produce una liberación lenta del gas. También se ha detectado que la irradiación con laser cierra el fulereno con el hidrógeno en su interior, obteniéndose el complejo H2@ C60.
Aparentemente me he desviado de la trayectoria que me había marcado pero no es así. Cuando el huésped o macho es estrecho y largo (que nadie entienda connotaciones sexuales en esta afirmación) los éteres corona forman los denominados rotaxanos. Estos rotaxanos los forman también las ciclodextrinas y otros macrociclos como cucurbituril, calixarenos, etc.
El término rotaxano se aplica a complejos químicos que tienen la particularidad de que una parte de los mismos (rueda) puede girar en torno a un componente lineal (eje). Como eje vale cualquier molécula lineal larga. La figura muestra un rotaxano en el que el compuesto lineal (macho) posee grupos voluminosos terminales que impiden la salida del macrociclo. Es obvio que entre ambos componentes no existe ninguna unión covalente. La bibliografía es rica en diversos tipos de rotaxanos: según la naturaleza de los grupos terminales del eje, cabezas terminales diferentes o no, la estructura química del eje y la rueda, o el número de ruedas por eje. En este último caso se denominan polirrotaxanos.
La siguiente figura resume los diferentes tipos de polirrotaxanos de los que tengo referencia. En el campo de las ciclodextrinas sólo se han obtenido los indicados en primer y segundo lugar.
Para obtener los polirrotaxanos lineales es necesario utilizar un eje polimérico como por ejemplo polietilenglicol, polipropilenglicol, poliisobutileno, etc. La estructura y estequiometría de los complejos formados están perfectamente determinadas y concuerdan con los datos conocidos de las dimensiones moleculares. En definitiva las ciclodextrinas actúan como perlas atravesadas por un hilo (polímero) por lo que Harada bautizó a este tipo de compuestos con el nombre de collares. En comparación con la formación de complejos con huéspedes simples, la formación de collares puede ser enormemente lenta abarcando periodos de varios meses de duración. El rendimiento en su obtención ha llegado hasta valores tan altos como el 68%.
Como continuación de su trabajo Harada tuvo la idea de unir covalentemente las ciclodextrinas insertadas y retirar posteriormente el polímero. El resultado fue la formación de una estructura tubular de masa molecular aproximadamente 2´104 g/mol, consistente con la masa molecular del polirrotaxano de partida. Por lo tanto, el tubo tiene del orden de 15 unidades de a-ciclodextrina.
Dejaré ahora aparcadas las ruedas.
En una conferencia pronunciada a finales de diciembre de 1959 Richard Philips Feynman afirmó lo siguiente:"De lo que quiero hablar es del problema de manipular y controlar objetos a muy pequeña escala. Tan pronto como lo menciono, se me habla de miniaturización y hasta donde se ha llegado en la actualidad. Se me habla de motores eléctricos del tamaño de una uña o del dedo meñique. Ya existe este dispositivo en el mercado, se me dice. Se me dice que se puede escribir una oración al Señor en la cabeza de un alfiler. Pero eso no es nada, eso es lo más arcaico. Un mundo asombrosamente pequeño subyace debajo. Hacia el año 2000, cuando se mire hacia esta época, se preguntarán por qué no fue hasta el año 1960 cuando alguien comenzó a moverse seriamente en esa dirección..."
Ya he mostrado algunos ejemplos de ese nanomundo al que Feynman se estaba refiriendo y, aunque son muchos los aspectos que hemos tenido que ir dejando en el tintero, para no agotar su paciencia e ir finalizando, hablaré de máquinas moleculares. Personalmente prefiero llamarlos simplemente motores porque, como rezan los libros de "Conocimiento del medio" de mis hijas "los motores son máquinas que transforman la energía en movimiento". También ya les he mostrado algunas imágenes de los motores de LEGO. ¿Qué nos ofrece la Química Supramolecular?
La metodología a seguir la resume el esquema adjunto en el que muestro que al recibir un estímulo externo (químico, electroquímico, fotoquímico, cambio de pH, etc.) una entidad supramolecular puede transformar su estructura y alcanzar una nueva geometría implicando un movimiento translacional o rotario de sus componentes. Además, el proceso ha de ser reversible, esto es, volver a su posición de partida cuando el estímulo es retirado o el artilugio recibe un contraestimulo. De este modo, el mecanismo funciona de una forma cíclica que es lo requerido por cualquier motor termodinámico o electromagnético. Ahora les mostraré algunos ejemplos.
Así, existen motores relacionados con el isomerismo traslacional. El esquema simplificado de la figura muestra un rotaxano cuyo macrociclo puede anclarse en dos posiciones diferentes, exhibiendo un movimiento de vaivén. En el ejemplo, un ciclofano tetracatiónico hospeda un huésped que posee dos unidades diferenciadas: una unidad bencidínica y un bifenol, siendo la primera de ellas más rica en electrones. Gracias a la interacción electrostática el ciclofano (recordemos tetracatiónico) se ubica sobre la unidad bencidínica, siendo esta ubicación del 100% en acetonitrilo a -44ºC. Por protonación de la bencidina, convertimos esta unidad en un catión por lo que se produce una repulsión electrostática que debilita la interacción huésped-hospedador haciendo que el ciclofano se traslade hacia la posición del bifenol. La conversión en catión de la unidad bencidínica puede conseguirse por protonación, estímulo químico, o por oxidación de la misma mediante un estímulo electroquímico o químico. Si se invierte el proceso, esto es, desprotonación o reducción de la bencidina, el sistema recobra su posición inicial. En defitiva el proceso es reversible.
El segundo de los ejemplos corresponde a un catenano. Los catenanos se forman por la unión mecánica de al menos dos compuestos cíclicos como muestro en la figura. Para conseguir el motor uno de los dos eslabones de la cadena debe girar siguiendo el aro del otro eslabón, exhibiendo un movimiento rotatorio. En el presente ejemplo el eslabón de la cadena que gira consiste en un éter corona que posee dos residuos diferentes ricos en electrones p: uno de ellos es un tetratiafulvaleno disustituido, al que denominaré abreviadamente TTF) y el otro es el residuo 1,5-dioxynaftaleno. En su estado más estable, la unidad TTF se ubica en el interior de la cavidad del ciclofano tetracatiónico. La oxidación química y/o electroquímica del TTF da un radical monocatiónico TTF+ o un dicatión TTF2+ por lo que, debido a la repulsión electrostática es expulsado de la cavidad tetracatiónica y reemplazado por el anillo neutro del dioxonaftaleno. En definitiva, se produce la rotación del poliéter macrocíclico. Esta acción va acompañada por un dramático cambio de color desde el verde (que corresponde a la situación inicial) hasta el púrpura (que corresponde al estado final). Si posteriormente se produce una reducción, química o electroquímica, se recupera el estado original.
El último de los ejemplos, diferente a los anteriores, corresponde al DNA e implica la utilización de la interconversión del B®Z del DNA, de la que ya he hablado con anterioridad. Para ello se conectan dos dobles moléculas entrecruzadas (en rojo y azul) a través de un segmento que contiene una región que permite la interconversión B®Z (en amarillo). La interconversión se consigue mediante la adición de cloruro de hexaaminocobalto (III) y el proceso se invierte por la extracción de este reactivo. En la figura los círculos indicados representan colorantes fluorescentes unidos al dispositivo que permiten demostrar la interconversión. Aunque no me detendré en ellos el DNA permite la consecución de otros dispositivos mecánicos.
Hace un momento afirmé que he tenido que dejar muchas cosas en el tintero. Por no mencionar más que algunas citaré las clásicas micelas, vesículas o membranas y los procesos de reconocimiento molecular, ensamblaje e interacción entre macromoléculas como proteínas y DNA tan importantes para la vida por estar relacionadas con aspectos como catálisis enzimática, encefalopatías espongiformes transmisibles (incluyendo la enfermedad de síndrome de Creutzfel-Jakob), etc. Tampoco he mencionado los procesos de autorreplicación o los fenómenos de cooperatividad que surgen en los procesos de ensamblaje. Al fin y al cabo, la química supramolecular no es más que una sociología molecular y, en este contexto, un virus no es más que una estructura supramolecular. Si espero haber puesto de manifiesto la importancia de la Química Supramolecular en relación con las denominadas nanotecnologías.
Permítaseme que finalice con las palabras de Jean-Marie Lehn referidas a lo que el futuro demandará de esta Química LEGO. Afirma este premio Nobel de Química que "hasta fechas recientes la Química no ha ahondado en la respuesta a las preguntas-¿Cómo se vuelve compleja la materia?-¿Cómo ha sido la evolución hacia sistemas más complejos, incluyendo los organismos inteligentes?¿Qué otras formas de materia compleja pueden ser desarrolladas y creadas? Como ciencia de la estructura y transformación de la materia, la Química otorga medios para interrogar el pasado, explorar el presente y construir puentes hacia el futuro". Fin de la cita.
En este camino a recorrer, será necesario diseñar y obtener compuestos cada vez más complejos. Cuando la Química Supramolecular afronta sistemas mayores y más complejos, el esfuerzo sintético se expande y el tiempo y el dinero representan aspectos de importancia creciente.
En cualquier caso, urge que España fomente la investigación en Química Supramolecular o perderá una vez más el tren en un campo de investigación del que, desde que se asentó de un modo definitivo la denominación supramolecular, no han pasado más que veinticinco años. Apenas aparecen nombres de españoles en esta investigación y algunos de ellos se encuentran asentados en el extranjero. Así que como he vuelto al comienzo de mi exposición, excluída la anacrusa referida al LEGO, al demandar más esfuerzo social dirigido a la investigación, me he convertido en una máquina parlante cíclica que, Excmo. y Magfco. Sr. Rector, o detiene o no callará nunca.http://www.xornal.usc.es/opinion_amp.asp?p=10779
NEODIMIO ¡no te lo pierdas!

-
Un campo de investigación reciente y muy interesante es el de las máquinas moleculares. Inspirándose en la mecánica biológica, muchos han bu...
-
De entre todos los compuestos químicos que existen, quizá sean los llamados compuestos de coordinación los que mayores dificultades ofrecen ...




